GYNECOLOGIE
Cancer de l’ovaire
Cancer de l’ovaire
- Contexte – Généralités
1.1. Définition
Néoformations malignes développées aux dépens des constituants du tissus ovarien. Les cancers épithéliaux sont les plus fréquents (85 à 90%).
1.2. Epidémiologie
Troisième cancer de la femme, il s’agit d’habitude d’un cancer de la femme ménopausée.
Il est le cancer gynécologique le plus létal. On estime à 5 348 le nombre de nouveaux cas de cancers de l’ovaire en 2023 en France avec 3500 décès et un âge moyen de 65 ans. Le retard au diagnostic fait que le taux de survie nette standardisée à 5 ans des personnes diagnostiquées du cancer de l’ovaire est de 43%. Son incidence mondiale est de 324603 avec une prédominance en Asie de 54% des cas sur 7,9% en Afrique. Avec une incidence de mortalité mondiale de 206954 dont 52,9% en Asie sur 8,7% en Afrique, où elle occupe le quatorzième rang des cancer dans le monde. Au Sénégal l’incidence du cancer était de 10,12 cas pour 100000 habitants soit 6,77% dont 2,6% de cancer de l’ovaire avec 260 nouveaux cas et 211 décès en 2022.
Le taux de décès par cancer des ovaires au Sénégal en 2020 a atteint 220 ou 0.28% des décès totaux.
Le cancer de l’ovaire provoque peu de symptômes. Ainsi, la grande majorité des patientes sont diagnostiquées à un stade avancé de leur cancer avec 60 à 80% des cas diagnostiqués au stade IIIC et IV.
1.3. Classifications : TNM 2018
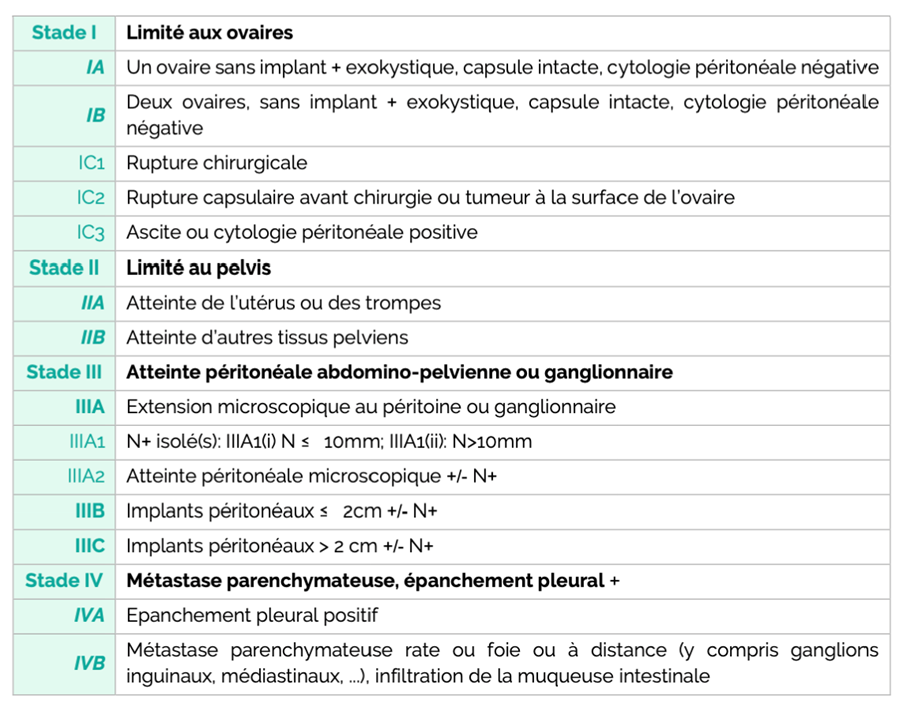
1.4. Classification histologique
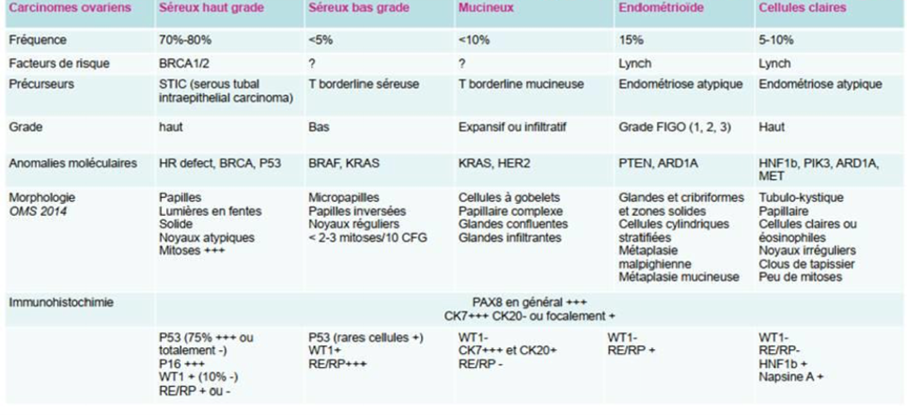
1.4. Particularités
1.5. Bases utiles
- Diagnostic clinique, paraclinique et évaluation initiale
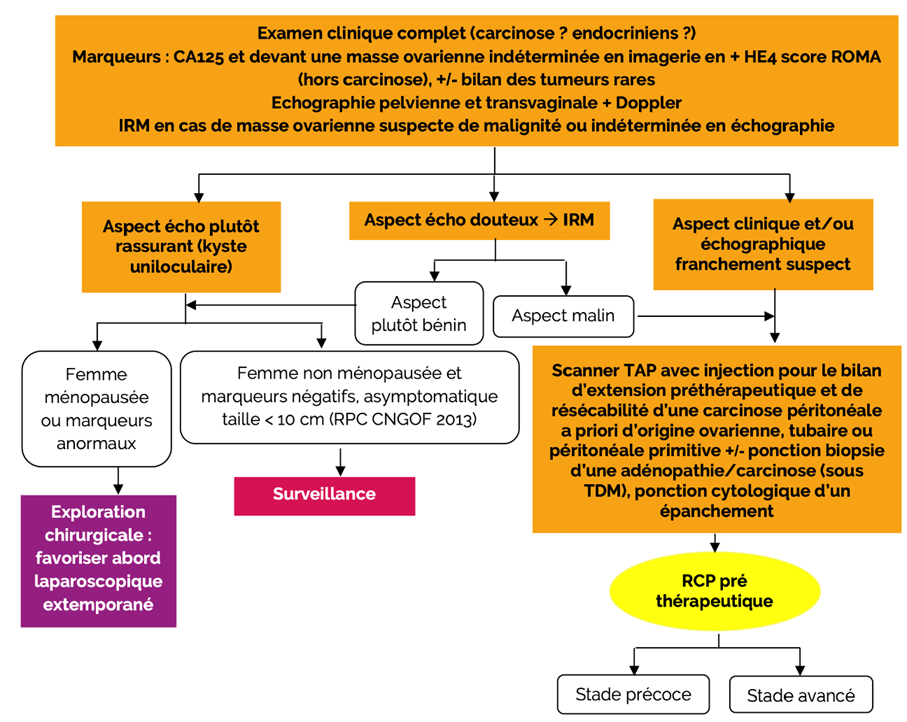
- Diagnostic paraclinique
3.1. Standards
– Échographie pelvienne
– IRM pelvienne en cas de doute
– Scanner thoracique, abdominal et pelvien
– Biopsies tumorales, de la carcinose (coelioscopie, laparotomie)
3.2. Recommandations locales
– Échographie pelvienne
– IRM pelvienne en cas de doute
– Scanner thoracique, abdominal et pelvien
– Biopsies tumorales, de la carcinose (coelioscopie, laparotomie, transpariétale)
- Traitement
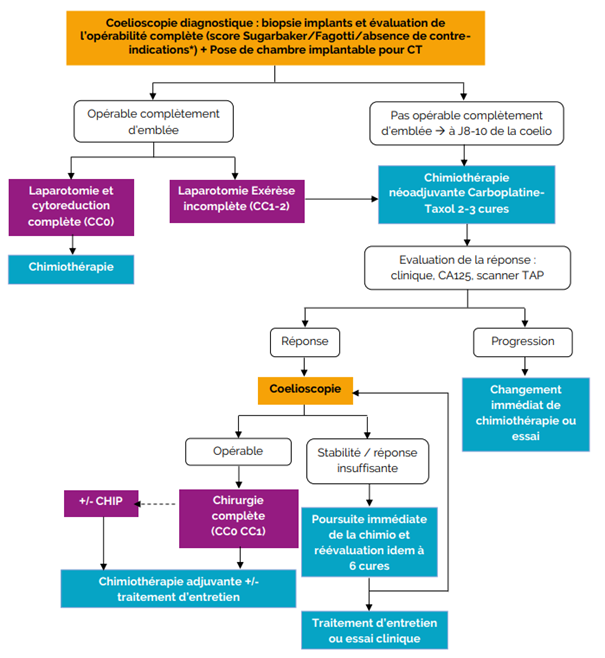
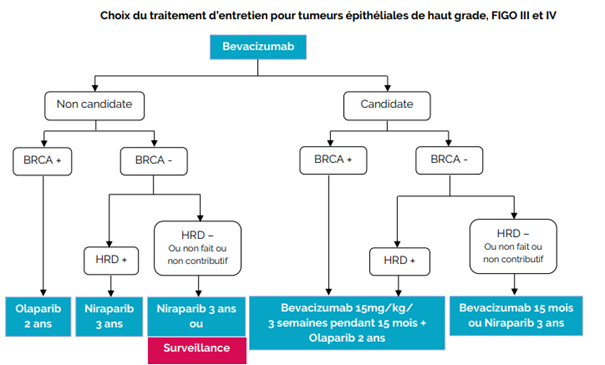
4.1. Standards
Chirurgie
Chirurgie Objectif
Exérèse macroscopiquement complète après évaluation péritonéale (PCI/sugarbaker), score d’opérabilité (Fagotti ou autres) après histologie confirmant le diagnostic.
– D’emblée opérables
Les gestes chirurgicaux doivent comporter une HTAB, Omentectomie (infracolique minimum et infragastrique en cas de lésion macroscopique), prélèvements péritonéaux étagés, appendicectomie, curages pelviens bilatéraux et lombo-aortique bilatéral infra-rénal
– D’emblée ou après chimiothérapie néoadjuvante pour IIIC selon âge, état général, nutritionnel et état local (TDM-Laparoscopie) et type tumoral.
– Cytoréduction complète avec péritonectomie pariétale totale (voie extrapéritonéale) surtout si carcinose pariétale diffuse, résection implants > destruction chaque fois que possible. Résections digestives avec stomie de protection des anastomoses possibles (2 anastomoses, colon non préparé, patiente fragile dénutrie âgée)
– Jamais chirurgie d’emblée si stade IV (sauf rate, gg inguinal isolé ou atteinte de la muqueuse intestinale isolée) : 6 cures de chimiothérapie puis discuter cytoréduction secondaire si réponse NB : Pour les stades IIB à IV La réalisation de lymphadénectomie lombo-aortiques et pelviennes est recommandée pour les cancers avancés de l’ovaire, de la trompe ou du péritoine primitif, quel que soit le type histologique, en cas de suspicion clinique ou radiologique d’adénopathie métastatique pelvienne et/ou lombo-aortique (Grade B).
En l’absence d’adénopathie suspecte clinique ou radiologique et en cas de chirurgie péritonéale complète macroscopique lors d’une chirurgie initiale, la lymphadénectomie peut être omise parce que cela ne modifie pas le traitement médical adjuvant ni la survie globale, tout en augmentant la morbidité (Grade B)
4.2. Recommandations locales
En général, les différentes procédures diagnostiques et thérapeutiques peuvent être respectées avec nos conditions de travail actuelles.
En l’absence d’une coelioscopie pour une stadification initiale, une laparotomie (minimale) d’exploration peut être réalisée.
- Surveillance
Elle se fait par l’intermédiaire du dosage du CA 125 et du scanner thoracique, abdominal et pelvien.
- Prévention
Une chirurgie mammaire et annexielle peut être réalisée en cas de mutation génétique BRCA.
Cancer de l’endomètre
Cancer de l’endomètre
- Contexte – Généralités
1.1. Définition
Néoformation maligne de la muqueuse endométriale.
Il est le cancer du corps utérin le plus fréquent.
1.2. Épidémiologie
En 2022, on dénombrait environ 420 000 nouveaux cas dans le monde (4.5 % des cancers de la femme). Ce taux situe cette localisation au 7ème rang en termes d’incidence, après le cancer du sein, du côlon-rectum, du poumon, du col de l’utérus, de la thyroïde et des cancers de la peau.
Le nombre de décès liés au cancer de l’endomètre dans le monde est estimé à 98 000.
Dans les pays industrialisés, en particulier en Amérique du Nord et en Europe, le cancer de l’endomètre est le cancer gynécologique le plus fréquent et le quatrième en incidence chez la femme, après les cancers du sein, du côlon et du poumon.
Avec 8 220 cas estimés, le cancer de l’endomètre est le cancer gynécologique le plus fréquent, se situant au quatrième rang des cancers chez la femme en termes d’incidence. Il compte pour environ 13 % de tous les cancers diagnostiqués chez la femme et il est plus fréquent que le cancer de l’ovaire.
L’ incidence annuelle, ajustée pour l’âge, pour 100 000 femmes est de 11,2. Elle est en légère augmentation depuis 2010.
Le risque cumulé de développer un cancer de l’endomètre au cours de l’existence (période 0–74 ans) est de l’ordre de 1,4 %.
Son incidence augmente après la ménopause, période où sont diagnostiqués plus des trois quarts des cas. De fait, l’incidence annuelle pour 100 000 femmes passe de 3,5 cas, pour les femmes de moins de 45 ans, à 80 cas après la ménopause.
1.3. Classifications
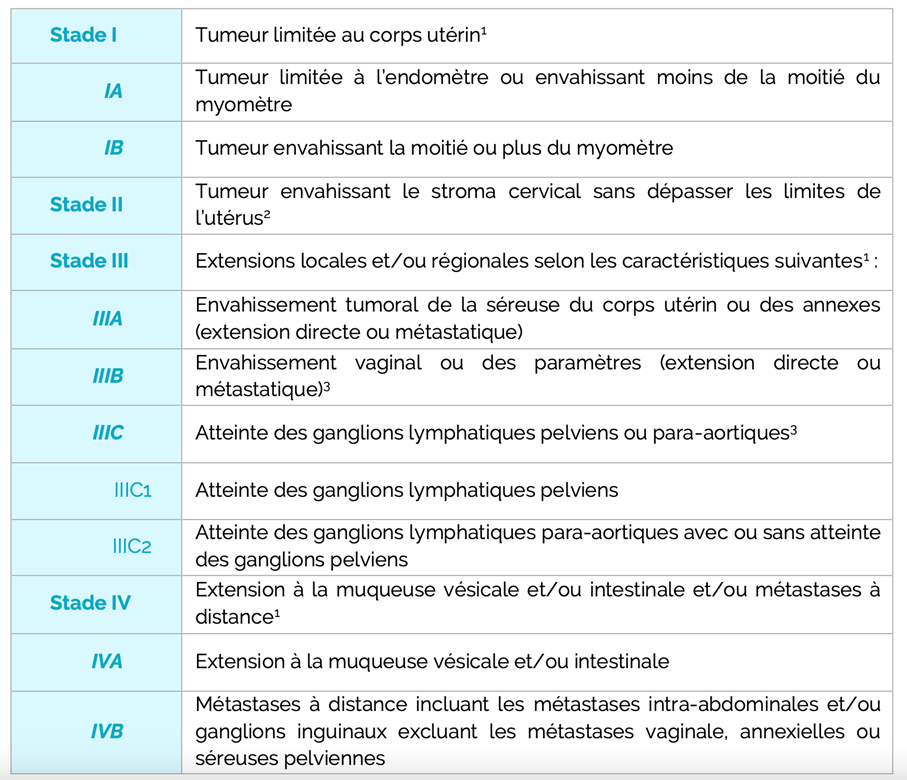
– Classification de la FIGO de 2018
– Classification moléculaire
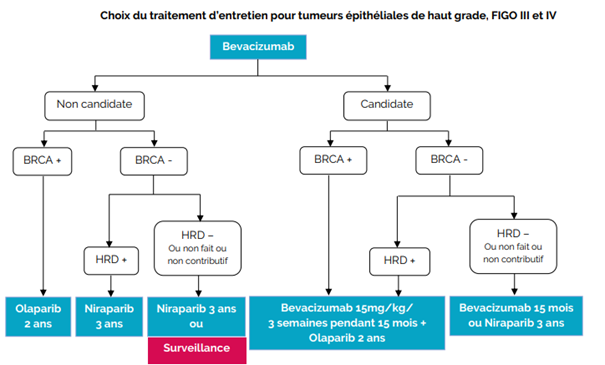
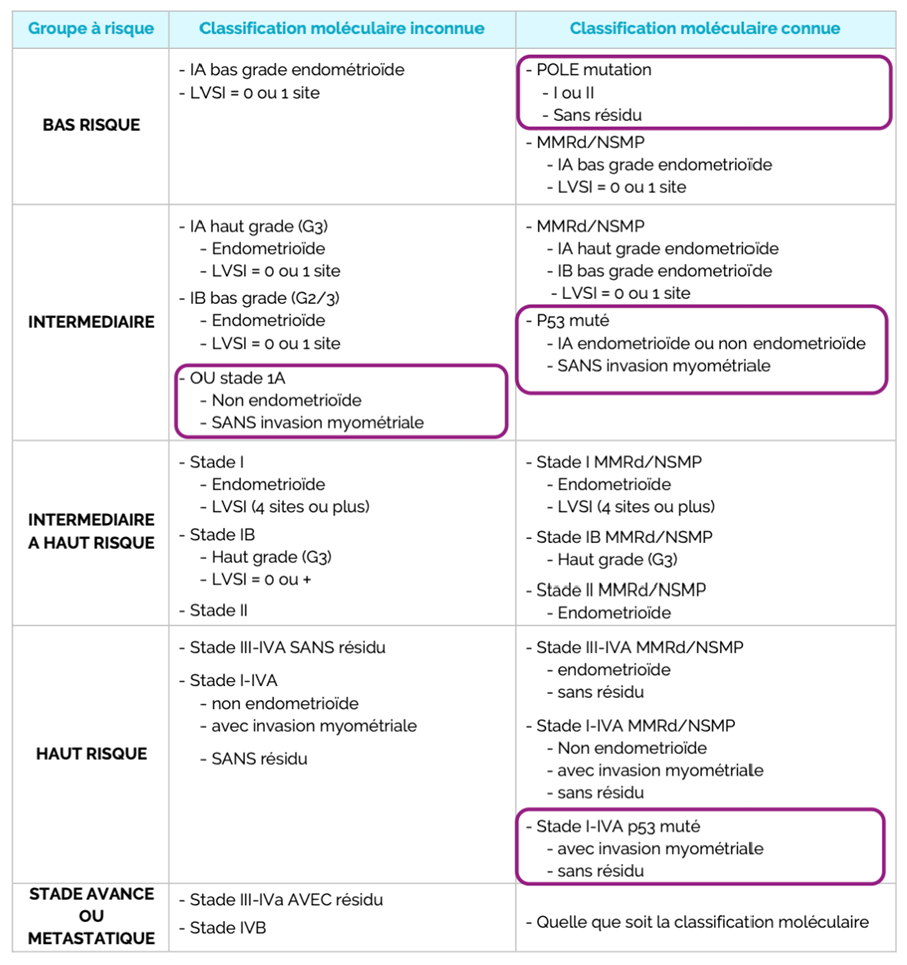
NB : Les encadrés en violets représentent les nouveautés thérapeutiques
- Particularités
- Bases utiles
- Diagnostic clinique
- Diagnostic paraclinique
3.1. Standards
- Antécédents familiaux
- Co-morbidités +/- évaluation gériatrique si nécessaire
- Examen clinique
- Biopsie endométriale
- Nouveau FIGO grading
Bas grade – Grades 1 et 2
Haut grade – Grade 3
- Profil p53 (sauvage ou muté)
- IRM pelvienne et abdominale
- Invasion myométriale
- Invasion stroma cervicale
- Ganglions pelviens et/ou aortiques suspects
- NB : en cas d’IRM uniquement pelvienne ne remontant pas jusqu’aux ganglions aortiques il est intéressant de compléter par un scanner abdomino-pelvien.
- Dosage CA 125 plasmatique
3.2. Recommandations locales
Idem
Le profil génétique p53 ne sera pas obligatoire pour toute la population et ne devrait pas retarder la prise en charge.
- Traitement
4.1. Standards
4.1.1. Stades précoces
Voie d’abord chirurgicale
- Privilégier la chirurgie mini invasive qui favorise une récupération plus rapide tout en évitant tout risque de contamination.
- La canulation utérine doit être évitée.
Procédures chirurgicales
- Hystérectomie totale extra-fasciale et annexectomie bilatérale
Elargie seulement si nécessité clinique pour les marges
- Option : préservation ovarienne
Peut être considérée chez femme de moins de 45 ans sans antécédents familiaux
évoquant un risque de cancer de l’ovaire (BRCA, Lynch, …) avec un adénocarcinome
endométrioïde de bas grade envahissant moins de 50% du myomètre au stade I
(dans certains cas la préservation ovocytaire peut être proposée)
Associée à une salpingectomie bilatérale
- Stadification ganglionnaire
Ganglion sentinelle pelvien
- Groupes à risque bas (avec pénétration myométriale) ou risque
- intermédiaire (sinon curage non recommandé en systématique)
- Pour les groupes à risque intermédiaire haut et haut risque (stade I ou II
- apparents) sinon curage pelvien et aortique
- En l’absence de ganglions suspects à l’IRM
- Diminue la morbidité et notamment le risque de lymphœdème
- Vert d’indocyanine supérieur en détection au bleu de méthylène
- Injection cervicale (que l’on peut répéter)
- Prioriser la détection bilatérale et en cas d’échec alors curage homolatéral
- dans les groupes à risque intermédiaire haut et haut
- La présence de cellules tumorales isolées n’impacte pas le pronostic et doit
- être classée : pN0(i+)
- En cas de statut ganglionnaire pelvien positif une stadification ganglionnaire
- para-aortique peut être proposée soit par imagerie (avec les limites de cette
- modalité) soit par chirurgie afin d’adapter les modalités du traitement
- adjuvant
- En cas de découverte d’un envahissement ganglionnaire en per opératoire alors debulking pelvien et para aortique doivent être réalisés (sans nécessité de curage ganglionnaire complet secondaire systématique)
- Omentectomie infracolique
o Pour carcinome séreux, carcinosarcome, carcinome indifférencié
- Restadification ganglionnaire +/- péritonéale après chirurgie incomplète
justifiée pour :
Groupes à risque intermédiaire et haut
Contre-indications médicales à chirurgie (dans un centre de référence)
Discuter une hystérectomie vaginale avec annexectomie bilatérale
Sinon radiothérapie définitive
Haut grade et/ou invasion myométriale profonde : radiothérapie ou curiethérapie
Bas grade : curiethérapie simple
Contre-indication à la chirurgie et à la radiothérapie
Hormonothérapie (acétate de médroxyprogestérone)
4.1.2. Stades avancés III et IV
- La chirurgie peut être considérée si la résection macroscopiquement complète est faisable (avec ablation des ganglions augmentés de volume sans curage complet) avec une morbidité acceptable dans des centres spécialisés avec bilan pré opératoire adéquat et discussion en réunion de concertation pluridisciplinaire
- Si chirurgie d’emblée non réalisable alors traitement systémique et chirurgie secondaire peut être envisagée en cas de bonne réponse.
- Prise en charge Maladie non résécable due à l’extension locale (à
discuter selon l’état de la patiente) :
- Radiothérapie définitive externe (avec chimiothérapie concomitante si possible) et avec curiethérapie intra-utérine
- Ou chimiothérapie néoadjuvante avant résection chirurgicale ou radiothérapie définitive en
fonction de la réponse.
- La chimiothérapie doit être considérée après radiothérapie définitive (afin de diminuer le risque métastatique à distance)
- Les indications de radiothérapie hémostatique doivent être bien pesées et réservées à des cas palliatifs sans aucune autre possibilité de traitement (Discuter les possibilités d’embolisation en cas de saignements)
Traitement adjuvant
Bas risque
- Stade IA (moins de 50% du myomètre) BG endométrioïde sans LVSI ou 1 site anomalie moléculaire
o Pas de traitement
o Pas de nécessité de rechercher POLE muté
Risque intermédiaire
- Endométrioide IA (moins de 50% du myomètre) HG, IB (plus de 50% du myomètre) BG sans
LVSI ou 1 LVSI sans anomalie moléculaire
o Curiethérapie (pouvant être évitée pour les < 60 ans)
- NON endométrioïde IA SANS invasion myométriale avec ou sans profil p53 muté
Pas de traitement
Option curiethérapie
- +++ La recherche de POLEmut peut éventuellement se faire s’il y a une indication de curiethérapie afin de l’éviter en cas de positivité. La curiethérapie du fond vaginal étant moins morbide, donc à discuter
- Endométrioïde stade I ≥ 4 LVSI
- Endométrioïde stade IB (plus de 50% du myomètre) HG +/- LVSI
- Endométrioïde stade II (atteinte du stroma cervical)
Risque haut
- Endométrioïde stades III-IVA sans résidu
- Endométrioïde stades I-IVA avec invasion myométriale sans résidu + profil p53 muté
- NON endométrioïde stades I-IVA avec invasion myométriale sans résidu
La PEC des cas particuliers sera discutée au cas par cas, notamment la prise en charge des récidives et de la préservation de la fertilité
4.2. Recommandations locales
Une chirurgie radicale première doit être envisagée en l’absence de contre-indication
Une omentectomie en cas de tumeur séreuse
La stadification ganglionnaire pelvienne est de mise, le niveau lombo-aortique en cas de tumeur de haut grade
Une chirurgie de seconde intention peut être possible si la résection initiale est impossible ou jugée dangereuse (plateau technique, morbidité importante)
Les traitements palliatifs doivent être développés
- Surveillance
- Prévention
- Primaire
- Secondaire
- Tertiaire
Cancer du col de l’utérus
Cancer du col de l’utérus
- Contexte – Généralités
- Définition
Néoplasie maligne primitive développée aux dépens d’un des constituants d col utérin.
Dans ce chapitre, nous traiterons les néoplasies épithéliales (carcinome épidermoïdes et adénocarcinomes)
b.Epidémiologie
c.Classifications
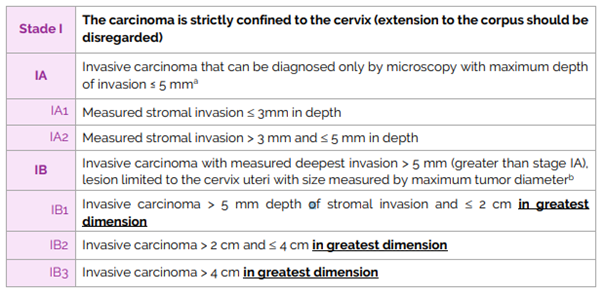
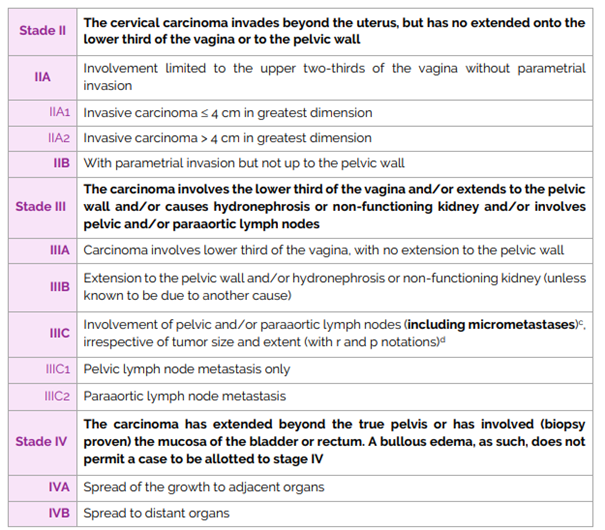
Moussa2. Diagnostic clinique et paraclinique
- Examen clinique : spéculum TV et TR ; sous AG si nécessaire ou douteux
- Biopsie
– Sous colposcopie si non évident cliniquement
– En pleine lésion si cliniquement évident (en zone non nécrotique)
- Imagerie
– IRM abdomino-pelvienne initiale, avant conisation si possible, avec injection de gadolinium – Taille tumorale, extension locale, ganglionnaire (pelviens et para aortiques)
– + TEP-TDM au FDG à partir de IB2 – +/- ponction de toute anomalie ganglionnaire ou viscérale accessible
- Biologie : – Bilan préopératoire standard / fonction consultation pré anesthésique, – Stade ≥ IB2 : SCC (épidermoïde) CA 125 (adénocarcinome) (en vue de surveillance) – NSE, chromogranine A si neuroendocrine
- Examens endoscopiques vésical et rectal si suspicion franche d’envahissement vésical ou rectal
- Standards
- Recommandations locales
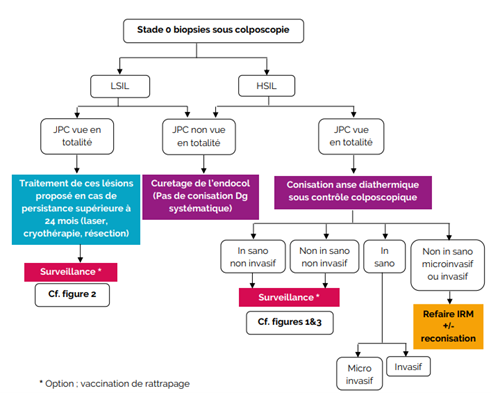
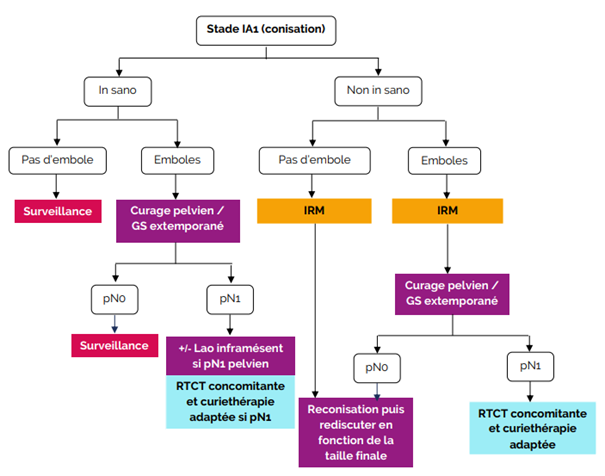
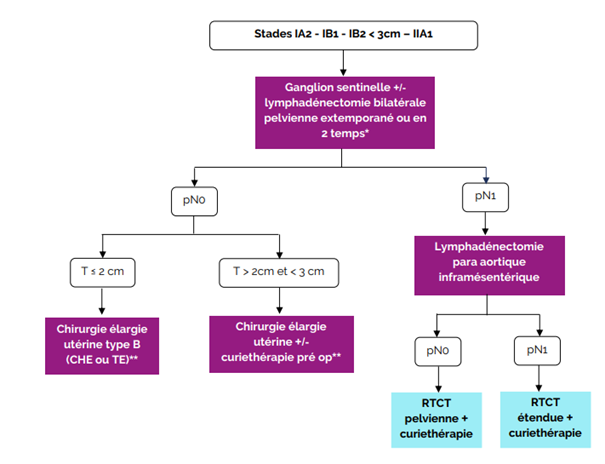
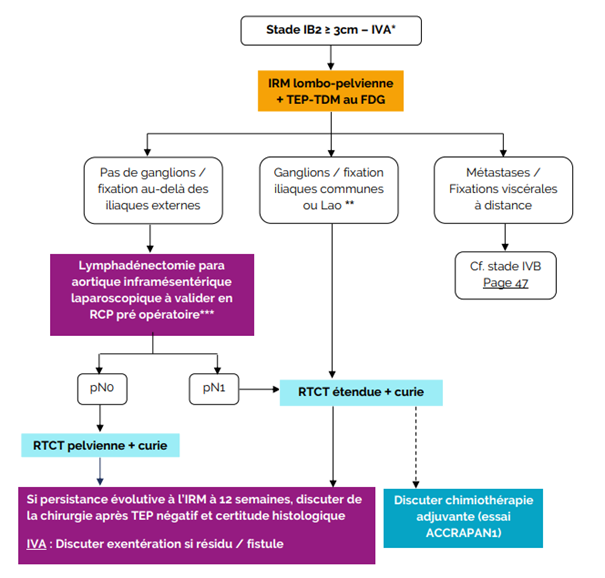

- Recommandations locales
- Surveillance
Surveillance post-thérapeutique
Les faits
- 90% des récidives surviennent au cours des deux premières années • 75% des récidives sont découvertes à l’examen clinique
- Mauvaise rentabilité des frottis systématiques surtout après radiothérapie
- Pas de contre-indication cancérologique à un traitement hormonal substitutif
- Education des patients sur les signes qui doivent alarmer La surveillance recommandée :
- Clinique seule pour formes précoces frottis facultatif sauf si traitement conservateur/chirurgical exclusif (discuté)
- En cas de difficulté de surveillance clinique après RTCT concomitante + curiethérapie, discuter surveillance par IRM et biologie
- Rythme visites ultérieures : tous les 3-4 mois au cours des 2 premières années, puis tous les 6 mois jusqu’à la 5ème année puis annuellement
- Sur signes d’appel (sauf cas particuliers) :
o IRM +/- ponction-biopsie écho ou scanno-guidée,
o Marqueurs : SCC/CA125 o Doute sur organicité d’une image profonde : TEP-TDM au FDG
- Traitement hormonal substitutif possible (en dehors des contre-indications classiques ou intolérance) par œstrogènes seuls si hystérectomie ou association oestro-progestative si utérus en place même après RTCT
Récidive Diagnostic
- Signes cliniques, élévation du marqueur (SCC/CA-125) à 2 dosages successifs ou imagerie selon symptômes Bilan
- Local :
o IRM lombo pelvienne o Examen clinique sous anesthésie générale éventuelle si indication chirurgicale possible (chirurgien + radiothérapeute) Ò biopsies (Tru-cut®/Cervicore®)
o Cystoscopie, rectoscopie éventuelle selon aspect clinique
- Local et à distance : TEP-TDM au FDG Localisée : Discuter cas par cas en centre de référence : voir le délai entre la fin de traitement et la survenue de la récidive, type du traitement reçu, statut ganglionnaire au diagnostic, âge de la patiente et état général entre autres facteurs avant de prendre la décision d’une chirurgie type exentération avec ou sans radiothérapie si marges +, traitement par chimio ou traitement par radiothérapie exclusive
- Prévention
- Primaire
- Secondaire
- Tertiaire
Sarcomes utérins
Sarcomes utérins
- Contexte – Généralités
1.1. Définition
Il s’agit de néoformations malignes développées aux dépens des cellules musculaires lisses, du stroma de l’endomètre, de l’utérus (myomètre).
Il s’agit d’un groupe de tumeurs, comprenant différents sous-types histologiques. Le diagnostic repose sur des critères morphologiques et immunohistochimiques en s’aidant de plus en plus de l’apport de la biologie moléculaire (FISH, PCR ou séquençage par RNA -seq, CGH array…).
1.2. Épidémiologie
Les sarcomes utérins sont des tumeurs rares, représentant moins de 3 % des tumeurs malignes du tractus génital féminin et entre 3 et 7 % des tumeurs malignes du corps utérin.
1.3. Classifications
Classification histologique des sarcomes Origine muqueuse :
Endometrial stromal sarcoma (ESS) = sarcome du chorion cytogène et adénosarcomes
- ESS de bas grade = myose stromale endolymphatique (15-20%)
- ESS de haut grade ou indifférencié (10-20%)
- Adénosarcomes (5%)
Origine fibre musculaire lisse : Léiomyosarcome (LMS) : 60% des sarcomes
- Agressivité en fonction du nombre de mitoses par grand champ (à préciser) / % nécrose / atypies nucléaires
- Difficultés diagnostiques : léiomyomes cellulaires, léiomyomatose intraveineuse, léiomyomatose péritonéale disséminée, léiomyome métastasiant bénin, STUMPS (relecture spécialisée anat path possible) A part = carcinosarcome (= anciens mixed mullerian sarcoma MMS) : Ne sont plus des sarcomes Ò mais en fait dédifférenciation des carcinomes endométrioïdes peu différenciés (cf. traitement par protocole endomètres non endométroïdes)
Léïomyosarcomes : stadification générale conventionnelle

Endométriaux et adénosarcomes
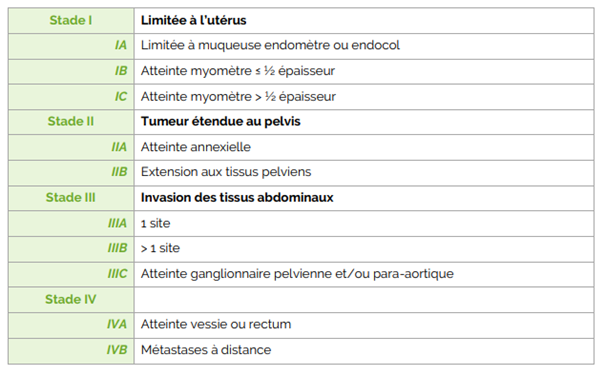
- Diagnostic clinique
- Diagnostic paraclinique
- Standards
- Recommandations locales
- Traitement
4.1. Standards
Principes thérapeutiques Chirurgie :
- Hystérectomie totale simple
- Annexectomie bilatérale de principe mais discutable si LMS et femme jeune, en revanche impérative si ESS de bas grade (à reprendre si non fait)
- Voie d’abord : laparotomie si volumineux ou doute diagnostique mais coeliochirurgie possible si faible taille sans morcellement ++++
- Lymphadénectomie inutile (sauf adénectomie de ganglion suspect)
Radiothérapie : à discuter au cas par cas
Chimiothérapie : Si indiquée, adriamycine – ifosphamide Hormonothérapie : Antiestrogènes pour ESS de bas grade car RE/RP souvent ++++
4.2. Recommandations locales
Les recommandations internationales peuvent valablement être employées localement.
Le véritable enjeu se situe au niveau du diagnostic pré opératoire et de la décision thérapeutique initialement.
- Surveillance
- Prévention
- Primaire
- Secondaire
- Tertiaire
Cancer du sein
Cancer du sein
- Contexte – Généralités
- Définition
- Epidémiologie
- Classifications
- Particularités
- Bases utiles
- Diagnostic clinique
- Diagnostic paraclinique
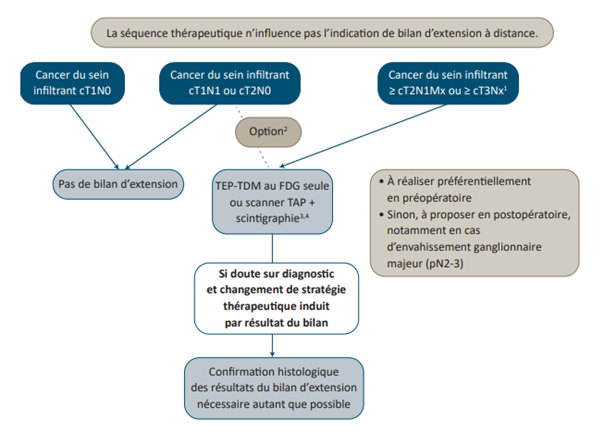
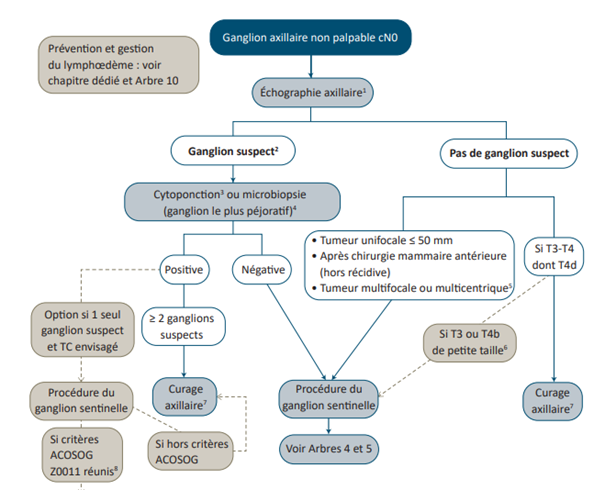
- Suspicion clinique et/ou radiologique confirmée :
- Examen clinique puis mammographie bilatérale + échographie mammaire bilatérale + échographie axillaire bilatérale1 +/– tomosynthèse addionnelle
- Biopsie de la lésion mammaire +/– pose de clip + en cas de ganglion(s) suspect(s) sur échographie, prélèvements ganglion(s) axillaire(s) + dans certaines situations, IRM , ou angio-mammographie
- Standards
- Recommandations locales
- Traitement
- Standards
- Recommandations locales
- Surveillance
- Prévention
- Primaire
- Secondaire
- Tertiaire