ONCO PEDIATRIE
Cancer de l’ovaire
Cancer de l’ovaire
- Background
- Définition
Les cancers de l’ovaires sont des tumeurs malignes se développant dans les ovaires. On distingue essentiellement 3 types chez l’enfant: Tumeurs germinales, Tumeurs épithéliales , Tumeurs des cordons sexuels et du stroma gonadique.
- Épidémiologie
Rare, 1% des tumeurs malignes de l’enfant
8-10% des masses annexielles
Fréquence variable selon les types histologiques
Tumeurs germinales 60–80 %. Deux pics de fréquence : avant 2 ans, adolescence
Tumeurs épithéliales : 15–20 %. Adolescence, après la ménarche
Tumeurs des cordons sexuels et du stroma gonadique: 10–20 %
Autres : Lymphome, métastatiques etc
Bon pronostic vital
Pronostic fonctionnelle : réserve ovarienne
- Particularités
Syndrome prédisposant
Maladie d’Ollier : Tumeurs à cellules de la granulosa juvéniles
Syndrome de Maffucci : Tumeurs à cellules de la granulosa juvéniles
Syndrome de Peutz-Jeghers : Tumeurs à cellules de Sertoli-Leydig
Syndrome DICER1 : Tumeurs à cellules de Sertoli-Leydig
Syndrome de Frasier syndrome : Tumeur stromale ou à cellules de Sertoli-Leydig
Syndrome de Denys–Drash : Tumeur stromale ou à cellules de Sertoli-Leydig
Syndrome de WAGR : Tumeur stromale ou à cellules de Sertoli-Leydig
Mosaïque 45, X/46, XY mosaicisme : Tumeur stromale ou à cellules de Sertoli-Leydig
- Rappels histologiques
-Tumeurs germinales
Dérive des cellule germinales pluripotente. Elles sont subdivisées en dysgerminome, tératome mature, tératome immature, tumeur du sac vitellin (Yolk Sac), carcinome embryonnaire, choriocarcinome non-gestationnel, tumeur germinale mixte, gonadoblastome.
Immunohistochimie: OCT3/4, C-Kit (CD117) (dysgerminoma)
BSALL4, LIN28 / AFP, glypican (GPC3), villine (Yolk sac)
CD30 et OCT3/4 Carcinome embryonaire
-Tumeurs des cellules épithéliales
Ces néoplasmes sont divisés en tumeurs séreuses, mucineuses, endométrioïdes, à cellules claires, séromucineuses et de Brenner.
Stade | Description | |||
FIGO | Fédération Internationale de Gynécologie et d’Obstétrique. | |||
I | Tumeur confinée à l’ovaire. | |||
IA | Tumeur limitée à un seul ovaire (capsule intacte) ; pas de tumeur sur la surface de l’ovaire ; pas de cellules malignes dans l’ascite ou les lavages péritonéaux. | |||
IB | Tumeur limitée aux deux ovaires (capsules intactes) ; pas de tumeur sur la surface de l’ovaire ; pas de cellules malignes dans l’ascite ou les lavages péritonéaux. | |||
IC | Tumeur limitée à un ou deux ovaires, avec l’une des caractéristiques suivantes : | |||
IC1 | Épanchement chirurgical. | |||
IC2 | Capsule rompue avant la chirurgie ou tumeur sur la surface de l’ovaire. | |||
IC3 | Cellules malignes dans l’ascite ou les lavages péritonéaux. | |||
II | Tumeur impliquant un ou deux ovaires avec extension pelvienne (en dessous de la ligne pelvienne) ou cancer péritonéal primaire. | |||
IIA | Extension et/ou implants sur l’utérus et/ou les trompes de Fallope. | |||
IIB | Extension à d’autres tissus intrapéritonéaux pelviens. | |||
III | Tumeur impliquant un ou deux ovaires ou cancer péritonéal primaire, avec propagation confirmée cytologiquement ou histologiquement au péritoine au-delà du pelvis et/ou métastase rétropéritonéale. | |||
IIIA1 | Ganglions lymphatiques rétropéritonéaux positifs uniquement (confirmés cytologiquement ou histologiquement) : | |||
IIIA1(i) | Ganglions lymphatiques ≤10 mm dans leur plus grande dimension. | |||
IIIA1(ii) | Ganglions lymphatiques >10 mm dans leur plus grande dimension. | |||
IIIA2 | Atteinte péritonéale microscopique extrapelvienne (au-dessus de la ligne pelvienne) avec ou sans ganglions rétropéritonéaux positifs. | |||
IIIB | Métastases péritonéales macroscopiques au-delà du pelvis ≤2 cm dans leur plus grande dimension, avec ou sans métastase aux ganglions rétropéritonéaux. | |||
IIIC | Métastases péritonéales macroscopiques au-delà du pelvis >2 cm, avec ou sans métastase aux ganglions rétropéritonéaux (incluant l’extension à la capsule du foie et de la rate sans atteinte parenchymateuse). | |||
IV | Métastases distantes, à l’exclusion des métastases péritonéales. | |||
IVA | Épanchement pleural avec cytologie positive. | |||
IVB | Métastases parenchymateuses et métastases aux organes extra-abdominaux (y compris les ganglions lymphatiques inguinaux et ganglions situés en dehors de la cavité abdominale). | |||
-Tumeurs des cordons sexuels et du stroma gonadique
Les tumeurs stromales des cordons sexuels proviennent des cellules des cordons sexuels, à savoir les cellules de la granulosa et de Sertoli, ainsi que des cellules stromales, notamment les fibroblastes, les cellules thécales et les cellules de Leydig. Elles sont classées en stromales pures, cordons sexuels pures et mixtes. Le tumeur des cellules de la granulosa juvénile et la tumeur des cellules de Sertoli-Leydig sont les types les plus courants chez les enfants.
Classification de FIGO
Stade I
- IA : Cancer limité à un ovaire ou une trompe de Fallope.
- IB : Cancer présent dans les deux ovaires ou trompes de Fallope.
- IC : Cancer dans un ou les deux ovaires ou trompes de Fallope avec des caractéristiques supplémentaires :
- IC1 : Rupture chirurgicale.
- IC2 : Rupture de la capsule avant la chirurgie ou tumeur à la surface de l’ovaire ou de la trompe de Fallope.
- IC3 : Cellules malignes dans les ascites ou les prélèvements péritonéaux.
Stade II
- IIA : Cancer étendu à l’utérus ou aux trompes de Fallope ou aux ovaires.
- IIB : Cancer étendu à d’autres organes pelviens tels que la vessie ou le rectum.
Stade III
- IIIA1 : Cancer étendu uniquement aux ganglions lymphatiques rétropéritonéaux.
- IIIA1(i) : Métastase ≤10 mm dans sa plus grande dimension.
- IIIA1(ii) : Métastase >10 mm dans sa plus grande dimension.
- IIIA2 : Cancer microscopique en dehors du pelvis avec ou sans ganglions lymphatiques rétropéritonéaux positifs.
- IIIB : Métastase péritonéale macroscopique au-delà du pelvis ≤2 cm dans sa plus grande dimension.
- IIIC : Métastase péritonéale au-delà du pelvis >2 cm dans sa plus grande dimension, pouvant impliquer la capsule du foie ou de la rate mais non leur parenchyme.
Stade IV
- IVA : Cellules cancéreuses dans le liquide pleural.
- IVB : Métastases à distance incluant les métastases parenchymateuses au foie ou à la rate, métastases à des organes extra-abdominaux (incluant les ganglions lymphatiques
- inguinaux et les ganglions lymphatiques hors de la cavité abdominale).
- Diagnostic clinique
- Interrogatoire
Douleur
Aménorrhée ou irrégularités menstruelles
Nausées
Vomissements
Troubles mictionnels
Troubles du transit
Évaluer le statut pubertaire
- Signes généraux
Anorexie
Perte de poids
Fièvre
- Signes physiques
Augmentation volume de l’abdomen
Masse abdomino-pelvienne
Signes précoces de puberté
Pertes/saignement vaginal
Symptômes de virilisation
- Diagnostic paraclinique
- Standards
- Biologie
CA-125
a-FP
β-HCG
Inhibine
LDH
Testostérone
- Imagerie
Échographie abdomino-pelvienne
Analyse de la tumeur Masse solide ou composante solide, mal limitée, hétérogène, >8-10 cm de diamètre, projection papillaire, présence d’ascite, signal Doppler élevé. Mensuration
Vascularisation
Extension ganglionnaire
Ascite
TDM thoraco-abdomino-pelvienne
Analyse de la tumeur Masse solide ou composante solide, mal limitée, hétérogène, >8-10 cm de diamètre, projection papillaire, présence d’ascite, signal Doppler élevé. Mensuration
Extension ganglionnaire
Ascite
IRM abdomino-pelvienne
Analyse de la tumeur Masse solide ou composante solide, mal limitée, hétérogène, >8-10 cm de diamètre, projection papillaire, présence d’ascite, signal Doppler élevé. Mensuration
Extension ganglionnaire
Ascite
Facteur de mauvais pronostic : type histologique (Yolk Sac), Extension local/métastase, αFP > 10000 ng/ml, HCG > 5000 UI/ml
- Recommandations locales
Examen clinique, Bilan biologique complet, échographie abdomino-pelvienne et TDM TAP en dehors d’urgence. Discussion en RCP.
- Traitement
- Standards
- Chirurgie première
Ovariectomie/ Annexectomie RO
Abord
Laparotomie : en 1ère intention
Laparoscopie : exploration, thérapeutique que si tumeur de moins de 5 cm (ovariectomie / salpingo-ovariectomie utilisation de sac endoscopique et ^as de fragmentation de la tumeur)
Technique
Prélèvement liquide péritonéal pour cytologie
Examen omentum et péritoine avec ablation de toute zone anormale
Inspection ovaire controlatéral avec biopsie uniquement des zones suspectes
Examen des ganglions iliaques et aorto-caves avec biopsie de tout ganglion anormal
Inspection de la tumeur : rupture, végétations, adhérences aux organes voisins
- Chimiothérapie
En fonction de l’anatomopathologie.
Pas de chimiothérapie si localisée et exérèse complète sauf tumeur de Yolk Sac.
Tumeur germinal: Cisplatine, etoposide, and bleomycin
Tératome immature: Vincristine, Dactynomycine et Cyclophosphamide
Tumeur de Yolk Sac : Vincristine, Dactynomycine et Cyclophosphamide
Choriocarcinome : actinomycin D, methotrexate, and chlorambucil
Tumeur des cordons sexuels: Bléomycine, Etoposide et Cisplatine
- Radiothérapie
Rare, seulement si échec traitement métastase par chimiothérapie
- Recommandations locales
Même recommendantions
- Surveillance
Cinq premières années : Examen physique et échographie abdominale
Tous les 3 mois pendant les deux premières années
Tous les 6 mois pendant les trois années suivantes
- Prévention
- Secondaire
-Surveillance des patients à risque génétique : Examen physique et échographie abdominale tous les 3 mois pendant 7 ans.
-Dépistage prénatal : Identification précoce de malformations pouvant passer inaperçu à la naissance et pouvant rentrer dans un cadre syndromique prédisposant.
-Conseil génétiques : Pour les familles avec une histoire de syndromes héréditaires pour identifier les enfants à haut risque.
- Tertiaire
-Suivi post-traitement rigoureux : Suivi régulier après traitement selon les recommandations,
-Réhabilitation et soins palliatifs : Pour les patients ayant survécu au cancer, fournir des services de réhabilitation pour traiter les effets secondaires à long terme du traitement
Cancer testiculaire/para-testiculaire
Cancer testiculaire/para-testiculaire
- Background
- Définition
Ensemble des tumeurs malignes se développant dans les testicules et les structures adjacentes au testicule.
Tumeurs testiculaires :Tumeurs germinales, tumeurs du cordon sexuel et du stroma gonadique, gonadoblastome
Tumeurs paratesticulaire : Rhabdomyosarcome
- Epidémiologie
Rare, 1 à 2% des cancers de l’enfant
2 pics : avant 5 ans et à l’adolescence
Tumeurs germinales 90%
- Particularités
Contexte prédisposant
Cryptorchidie prise en charge tardivement : Tumeurs testiculaires (séminome ++)
Dysgénésie gonadique: Tumeurs testiculaires
Anomalie des organes génitaux externes: Tumeurs testiculaires
Antécédents personnel et familiale de cancer du testicule
Syndrome de Peutz–Jeghers : Tumeurs testiculaires
Syndrome de Carney: Tumeurs testiculaires
Syndrome de DICER1 : Tumeurs testiculaires
Synrome de Li-Fraumeni (p53) : Tumeur para-testiculaires
Syndrome de Costello : Tumeur para-testiculaires
Syndrome de Noonan (RASopathies) : Tumeur para-testiculaires
- Rappels histologique
-Tumeurs germinales
Dérive des cellule germinales pluripotente. Elles sont subdivisées en séminome, tératome mature, tératome immature, tumeur du sac vitellin (Yolk Sac), carcinome embryonnaire, choriocarcinome non-gestationnel, tumeur germinale mixte, gonadoblastome.
Immunohistochimie: OCT3/4, C-Kit (CD117) (dysgerminoma)
BSALL4, LIN28 / AFP, glypican (GPC3), villine (Yolk sac)
CD30 et OCT3/4 Carcinome embryonaire
-Tumeurs des cordons sexuels et du stroma gonadique
Les tumeurs stromales des cordons sexuels proviennent des cellules des cordons sexuels, à savoir les cellules de la granulosa et de Sertoli, ainsi que des cellules stromales, notamment les fibroblastes, les cellules thécales et les cellules de Leydig. Elles sont classées en stromales pures, cordons sexuels pures et mixtes. Le tumeur des cellules de la granulosa juvénile et la tumeur des cellules de Sertoli-Leydig sont les types les plus courants chez les enfants.
Classification des tumeurs testiculaires
Stade | Description COG | Stade AJCC approximatif |
I | – Limité au testicule avec marges négatives via orchidectomie inguinale haute | N0 → I |
– Excision lors de la même opération | ||
– NED (aucune évidence de maladie) au-delà du testicule | ||
– Tous les ganglions lymphatiques < 1 cm en axe court | ||
II/III | – Violation de la capsule tumorale | Nany → II |
– Marge positive au scrotum ou < 5 cm de la marge du cordon | ||
– Échec des marqueurs tumoraux à se normaliser ou diminuer avec une demi-vie appropriée | ||
– Excision avec biopsie et orchidectomie scrotale sans violation et ligature du cordon au niveau de l’anneau interne | ||
III | – Ganglions lymphatiques rétropéritonéaux (+RPLNs) sans atteinte viscérale ou extra-abdominale | M1 → III |
– Ganglions lymphatiques ≥ 2 cm en axe court | ||
– Ganglions lymphatiques de 1 à 2 cm en imagerie qui ne se résolvent pas en 4 à 6 semaines | ||
IV | – Métastases distantes au foie, poumon, cerveau, os | – |
-Métastases : lymphome, leucémies
-Rhabdomyosarcome (tumeur para-testiculaires)
Tumeurs mésenchymateuse maligne
-RMS alvéolaire (15-20%)
T(2;13) (q35-q14) -> gène de fusion PAX3-FOXO1 (70%)
T(1;13) -> PAX7-FOXO1 (15-25%)
-RMS embryonnaire (80%):
botrioïde ou à cellules fusiformes
perte de l’hétérozygoGe 11p15 / gains de matériel sur les chromosomes 2, 8, 12 ou 13
Tableau 3: Système de classification du stade pour les nouveaux patients atteints de RMS | |||||
Stade | Emplacement | Statut T | Taille | Etat des ganglions | Métastases |
1 | Favorable | T1 ou T2 | a ou b | N0, N1, ou NX | M0 |
2 | Défavorable | T1 ou T2 | a | N0 ou NX | M0 |
3 | Défavorable | T1 ou T2 | a | N1 | M0 |
3 | Défavorable | T1 ou T2 | b | N0, N1, ou NX | M0 |
4 | Favorable ou Défavorable | T1 ou T2 | a ou b | N0 ou N1 | M1 |
Table 4: Intergroup Rhabdomyosarcoma Group (IRSG) Clinical Group staging system for patients with newly diagnosed RMS | |
Groupe clinique | Définition |
I | Résection complète, marges négatives |
IIa | Résection complète, marges négatives |
IIb | Résection complète, marges négatives, ganglions réséqués positifs |
IIc | Résection complète, marges négatives, ganglions réséqués positifs |
III | Reste de tumeur visible (inclut les ganglions régionaux non réséqués) |
IV | Métastases distantes |
Risque :
- Risque standard , sous-groupe A:
Stade 1, Groupe I ou II
Stade 2 groupe I
- Risque standard , sous-groupe B:
Stade 1, Groupe III
Stade 2, Groupe II
Stade 3, Groupes I et II
- Risque intermédiaire:
Stades 2 et 3, Groupe III
Stade 4 groupe IV
RMS alvéolaire non métastatique
- Risque élevé:
RMS alvéolaire métastastique
RMS embryonnaire métastatiques > 10 ans ou < 1 an
- Diagnostic clinique
- Interrogatoire
Augmentation progressive du volume scrotal généralement indolore
Douleur (hémorragie intra-tumorale)
Évaluer le statut pubertaire
- Signes généraux
Anorexie
Perte de poids
Fièvre
- Signes physiques
Signes précoces de puberté
Gynécomastie
Augmentation volume du scrotum
Masse souvent indolore
Rechercher signe de Chevassu
Hydrocèle
- Diagnostic paraclinique
- Standards
- Biologie
a-FP
β-HCG
Inhibine
LDH
Oestrogène, testostérone, inhibine, hormone antimullérienne : si signes endocriniens
- Imagerie
Échographie testiculaire doppler et pelvienne
Siège : intra-testiculaire ou para-testiculaire
Analyse de la tumeur : Hypoéchogènes et homogènes, mais elles peuvent également être hétérogènes avec des composantes solides, kystiques ou calcifiées.
Vascularisation : perfusion augmentée
Extension ganglionnaire
Testicule controlatéral
Échographie à contraste
Élastographie
TDM TAP et scrotale
Analyse de la tumeur
Extension ganglionnaire
Métastase
IRM abdomino-pelvienne et scrotale
Analyse de la tumeur
Extension ganglionnaire
Métastase
Facteur de mauvais pronostic : type histologique (Yolk Sac), Extension local/métastase, αFP > 10000 ng/ml, HCG > 5000 UI/ml
- Recommandations locales
Un interrogatoire exhaustif est indispensable. Dans notre contexte, il est important de rechercher une notion de contage tuberculeux ainsi que des signes d’imprégnation tuberculeuse. Il ne faut pas non plus oublier de questionner sur la baignade en eau douce afin d’exclure la tuberculose et la bilharziose qui sont des diagnostic différentiels.
Biologie
Échographie doppler scrotale
TDM TAP
Discussion en RCP
- Traitement
- Standards
- Chirurgie
Indication
Chirurgie première devant toute suspicion de tumeur maligne
-Testicule
Abord inguinal
Clampage 1er des vaisseaux spermatiques
Extériorisation du testicule par voie inguinale ou par voie scrotale si testicule trop volumineux
Biopsie protégée
Examen extemporané
Tumorectomie si tératome ou t. Sertoli Leydig
Orchidectomie dans tous les autres cas avec résection du cordon spermatique
Curage lombo-aortique
-Paratesticulaire
Chirurgie radicale avec orchidectomie par voie inguinale
Si extension locale, chirurgie large mais non mutilante
Curage inguinal iliaque
- Chimiothérapie
En fonction de l’anatomopathologie et de l’évolution des marqueurs et de l’âge.
Pré-pubertaire
Pas de chimiothérapie si localisée, exérèse complète et normalisation des marqueurs (Stade 1)
Si métastase, chimiothérapie à base de platine.
Post-pubertaire
Pas de chimiothérapie si stade I
>Stade 1 : Bleomycin, etoposide et cisplatine
- Radiothérapie
Rare, seulement si échec traitement métastase par chimiothérapie
- Recommandations locales
Mêmes indications
- Surveillance
Cinq premières années : Examen physique et échographie scrotale
Tous les 3 mois pendant les deux premières années
Tous les 6 mois pendant les trois années suivantes
- Prévention
- Secondaire
-Surveillance des patients à risque génétique : Examen physique et échographie abdominale tous les 3 mois jusqu’à l’adolescence.
-Dépistage prénatal : Identification précoce de malformations pouvant passer inaperçu à la naissance et pouvant rentrer dans un cadre syndromique prédisposant.
-Conseil génétiques : Pour les familles avec une histoire de syndromes héréditaires pour identifier les enfants à haut risque.
-Dépistage des testicules non descendu après l’âge de 6 mois
-Prise en charge précoce des testicules non descendus
- Tertiaire
-Suivi post-traitement rigoureux : Suivi régulier après traitement selon les recommandations,
-Réhabilitation et soins palliatifs : Pour les patients ayant survécu au cancer, fournir des services de réhabilitation pour traiter les effets secondaires à long terme du traitement
Cancer vagin/utérus
Cancer vagin/utérus
- Background
- Définition
Tumeurs malignes localisé au niveau du vagin ou de l’utérus. Il s’agit le plus souvent du Rhabdomyosarcome et des tumeurs germinales chez l’enfant.
- Épidémiologie
Rare
Rhabdomyosarcome (RMS) est le 1er sarcome des tissus mous pédiatrique
18% des RMS : filière génitale de la fille (localisation favorable)
50% des tumeurs uro-génitales
TGM : avant 2 ans, adolescence Pic à 10 mois
RMS : 2 ans
Survie globale : 80% dans les pays développées
40% guérison par chimiothérapie seule
- Particularités
Contexte prédisposant
Synrome de Li-Fraumeni (p53)
Syndrome de Costello
Syndrome de Noonan (RASopathies)
- Rappels histologique
-Tumeurs germinales
Dérive des cellule germinales pluripotente. Elles sont subdivisées en dysgerminome, tératome mature, tératome immature, tumeur du sac vitellin (Yolk Sac), carcinome embryonnaire, choriocarcinome non-gestationnel, tumeur germinale mixte, gonadoblastome.
Immunohistochimie: OCT3/4, C-Kit (CD117) (dysgerminoma)
BSALL4, LIN28 / AFP, glypican (GPC3), villine (Yolk sac)
CD30 et OCT3/4 Carcinome embryonaire
-Rhabdomyosarcome
Tumeurs mésenchymateuses malignes
RMS alvéolaire
(15-20%)
T(2;13) (q35-q14) -> gène de fusion PAX3-FOXO1 (70%)
T(1;13) -> PAX7-FOXO1 (15-25%)
RMS embryonnaire (80%)
Variant : Botrioïde ou à cellules fusiformes
Immunohistochimie : Desmine, Myogénine
perte de l’hétérozygotie 11p15 / gains de matériel sur les chromosomes 2, 8, 12 ou 13
Tableau 3: Système de classification du stade pour les nouveaux patients atteints de RMS | |||||
Stade | Emplacement | Statut T | Taille | Etat des ganglions | Métastases |
1 | Favorable | T1 ou T2 | a ou b | N0, N1, ou NX | M0 |
2 | Défavorable | T1 ou T2 | a | N0 ou NX | M0 |
3 | Défavorable | T1 ou T2 | a | N1 | M0 |
3 | Défavorable | T1 ou T2 | b | N0, N1, ou NX | M0 |
4 | Favorable ou Défavorable | T1 ou T2 | a ou b | N0 ou N1 | M1 |
Table 4: Intergroup Rhabdomyosarcoma Group (IRSG) Clinical Group staging system for patients with newly diagnosed RMS | |
Groupe clinique | Définition |
I | Résection complète, marges négatives |
IIa | Résection complète, marges négatives |
IIb | Résection complète, marges négatives, ganglions réséqués positifs |
IIc | Résection complète, marges négatives, ganglions réséqués positifs |
III | Reste de tumeur visible (inclut les ganglions régionaux non réséqués) |
IV | Métastases distantes |
Risque :
- Risque standard , sous-groupe A:
Stade 1, Groupe I ou II
Stade 2 groupe I
- Risque standard , sous-groupe B:
Stade 1, Groupe III
Stade 2, Groupe II
Stade 3, Groupes I et II
- Risque intermédiaire:
Stades 2 et 3, Groupe III
Stade 4 groupe IV
RMS alvéolaire non métastatique
- Risque élevé:
RMS alvéolaire métastastique
RMS embryonnaire métastatiques > 10 ans ou < 1 an
- Diagnostic clinique
- Interrogatoire
Douleurs abdominales
Hémorragie génitale
Lésion extériorisée au périnée
Troubles mictionnels
Trouble du transit
- Signes généraux
Anorexie
Perte de poids
Fièvre
- Signes physiques
Hémorragie génitale
Lésion extériorisée au périnée
Examen du périnée et toucher rectal
Recherche d’adénopathies
- Diagnostic paraclinique
- Standards
- Biologie
-NFS, GsRH, hémostase
-AFP
-HCG
-Créatininémie, urémie, ionogramme sanguin, ionogramme urinaire
- Imagerie
Échographie abdomino-pelvienne
Analyse de la tumeur : taille, siège, extension locale
Extension ganglionnaire
Métastase
TDM TAP
Analyse de la tumeur
Extension ganglionnaire
Métastase
IRM abdomino-pelvienne
Analyse de la tumeur
Extension ganglionnaire
Métastase
Biopsie
Endoscopie vaginale et utérine
- Recommandations locales
Examen clinique
Biologie
Échographie abdomino-pelvienne
TDM TAP
Discussion en RCP
- Traitement
- Standards
- Chimiothérapie
Néoadjuvante
Ifosfamide, vincristine et actinomycine
- Chirurgie
Conservatrice
Résection du résidu
Double abord : Approche abdominale (partie sup du vagin)
Approche périnéale (partie inférieure du vagin)
Transposition ovarienne
- Radiothérapie
Curithérapie : 60 Gy en impulsions horaires continues de 0,42 Gy par heure (10 Gy par jour)
Radiothérapie externe dans les formes avec extension locale et/ou ganglionnaire
- Recommandations locales
Mêmes indications
- Surveillance
Cinq premières années : Examen physique et échographie scrotale
Tous les 3 mois pendant les deux premières années
Tous les 6 mois pendant les trois années suivantes
Jusqu’à la fin de la croissance : surveillance des effets secondaire du traitement local
- Prévention
- Secondaire
-Surveillance des patients à risque génétique : Examen physique et échographie abdomino-pelvienne tous les 3 mois jusqu’à l’adolescence.
-Dépistage prénatal : Identification précoce de malformations pouvant passer inaperçu à la naissance et pouvant rentrer dans un cadre syndromique prédisposant.
-Conseil génétiques : Pour les familles avec une histoire de syndromes héréditaires pour identifier les enfants à haut risque.
- Tertiaire
-Suivi post-traitement rigoureux : Suivi régulier après traitement selon les recommandations,
-Réhabilitation et soins palliatifs : Pour les patients ayant survécu au cancer, fournir des services de réhabilitation pour traiter les effets secondaires à long terme du traitement
Cancer vessie/prostate
Cancer vessie/prostate
Cancer vessie/prostate
- Background
- Définition
Tumeurs malignes localisé au niveau de la vessie ou de la prostate. Il s’agit le plus souvent du Rhabdomyosarcome chez l’enfant.
- Épidémiologie
Rare
Rhabdomyosarcome (RMS) est le 1er sarcome des tissus mous pédiatrique
15% des RMS : tractus génito-urinaire (localisation favorable)
50% des tumeurs uro-génitales
2 pics : 2-5 ans, 15-19 ans
Survie globale : 80% dans les pays développées
- Particularités
Contexte prédisposant
Synrome de Li-Fraumeni (p53)
Syndrome de Costello
Syndrome de Noonan (RASopathies)
- Rappels histologique
Tumeurs mésenchymateuses malignes
-RMS alvéolaire
(15-20%)
T(2;13) (q35-q14) -> gène de fusion PAX3-FOXO1 (70%)
T(1;13) -> PAX7-FOXO1 (15-25%)
-RMS embryonnaire (80%)
Variant : Botrioïde ou à cellules fusiformes
Immunohistochimie : Desmine, Myogénine
perte de l’hétérozygotie 11p15 / gains de matériel sur les chromosomes 2, 8, 12 ou 13
Tableau 3: Système de classification du stade pour les nouveaux patients atteints de RMS | |||||
Stade | Emplacement | Statut T | Taille | Etat des ganglions | Métastases |
1 | Favorable | T1 ou T2 | a ou b | N0, N1, ou NX | M0 |
2 | Défavorable | T1 ou T2 | a | N0 ou NX | M0 |
3 | Défavorable | T1 ou T2 | a | N1 | M0 |
3 | Défavorable | T1 ou T2 | b | N0, N1, ou NX | M0 |
4 | Favorable ou Défavorable | T1 ou T2 | a ou b | N0 ou N1 | M1 |
Table 4: Intergroup Rhabdomyosarcoma Group (IRSG) Clinical Group staging system for patients with newly diagnosed RMS | |
Groupe clinique | Définition |
I | Résection complète, marges négatives |
IIa | Résection complète, marges négatives |
IIb | Résection complète, marges négatives, ganglions réséqués positifs |
IIc | Résection complète, marges négatives, ganglions réséqués positifs |
III | Reste de tumeur visible (inclut les ganglions régionaux non réséqués) |
IV | Métastases distantes |
Risque :
- Risque standard , sous-groupe A:
Stade 1, Groupe I ou II
Stade 2 groupe I
- Risque standard , sous-groupe B:
Stade 1, Groupe III
Stade 2, Groupe II
Stade 3, Groupes I et II
- Risque intermédiaire:
Stades 2 et 3, Groupe III
Stade 4 groupe IV
RMS alvéolaire non métastatique
- Risque élevé:
RMS alvéolaire métastastique
RMS embryonnaire métastatiques > 10 ans ou < 1 an
- Diagnostic clinique
- Interrogatoire
Douleurs abdominales
Dysurie
Rétention aigüe d’urines
Hématurie
Lésion extériorisée au périnée
Trouble du transit
- Signes généraux
Anorexie
Perte de poids
Fièvre
- Signes physiques
Hématurie
Lésion extériorisée au périnée
Examen du périnée et toucher rectal
Recherche d’adénopathies
- Diagnostic paraclinique
- Standards
- Biologie
-NFS, GsRH, hémostase
-Créatininémie, urémie, ionogramme sanguin, ionogramme urinaire
-ECBU
- Imagerie
Échographie abdomino-pelvienne
Analyse de la tumeur : taille, siège, extension locale
Extension ganglionnaire
Retentissement sur le haut appareil urinaire
TDM TAP
Analyse de la tumeur
Extension ganglionnaire
Métastase
Retentissement sur le haut appareil urinaire
IRM abdomino-pelvienne
Analyse de la tumeur
Extension ganglionnaire
Métastase
Biopsie
Endoscopie pour la vessie (Pas de biopsie percutanée ou de KT sus-pubien)
Échoguidée pour la prostate
Co-axiale
Introducteur : 16/18 G
Cyto-aspiration : 22 G
Biopsie : 16/18 G
- Recommandations locales
Examen clinique
Biologie
Échographie abdomino-pelvienne
TDM TAP
Discussion en RCP
- Traitement
- Standards
- Chimiothérapie
Néoadjuvante
Ifosfamide, vincristine et actinomycine
- Chirurgie
Conservatrice
Cystectomie partielle +/- réimplantation urétérale
Mucosectomie
Prostatectomie partielle (Résidu macroscopique accepté)
Tubes de curiethérapie placés en per-opératoire
- Radiothérapie
Curithérapie : bas débit pulsé (tumeurs de moins de 5cm)
Radiothérapie externe dans les formes avec extension locale et/ou ganglionnaire
- Recommandations locales
Mêmes indications
- Surveillance
Cinq premières années : Examen physique et échographie scrotale
Tous les 3 mois pendant les deux premières années
Tous les 6 mois pendant les trois années suivantes
Jusqu’à la fin de la croissance : surveillance des effets secondaire du traitement local
- Prévention
- Secondaire
-Surveillance des patients à risque génétique : Examen physique et échographie abdomino-pelvienne tous les 3 mois jusqu’à l’adolescence.
-Dépistage prénatal : Identification précoce de malformations pouvant passer inaperçu à la naissance et pouvant rentrer dans un cadre syndromique prédisposant.
-Conseil génétiques : Pour les familles avec une histoire de syndromes héréditaires pour identifier les enfants à haut risque.
- Tertiaire
-Suivi post-traitement rigoureux : Suivi régulier après traitement selon les recommandations,
-Réhabilitation et soins palliatifs : Pour les patients ayant survécu au cancer, fournir des services de réhabilitation pour traiter les effets secondaires à long terme du traitement
CORTICOSURRENALOME
CORTICOSURRENALOME
-Définition
Tumeur développée à partir du cortex surrénalien, rares
-Epidémiologie
Rare, un à deux cas par an en France
-Particularités
Prédisposition génétiques: syndrome de Li-F, NEM type1, syndrome de B-W, syndrome de Gardner
Oncogénétique
DIAGNOSTIC CLINIQUE
HTA
Signes de puberté précoce ou de virilisation majeure
Rarement masse palpable
DIAGNOSTIC PARACLINIQUE
Biologie: sur sang et urines
GlucoC:cortisol
minéralloC: aldostérone, rénine
Stéroides: testostérone, oestradiol, DHEA-s
Imagerie: Echo, TAP-TDM, IRM, TEP-DFG
CLASSIFICATION TNM (4 stades)
Anatomo-pathologie
Biopsie ou pièce d’exérèse chirurgicale
Type cytologique : score de Weiss >3
Facteurs pronostiques:
Tumeur localisée ou métastatique
Score de Weiss
Existence ou non d’une hypersécrétion
Possibilités d’exérèse chirurgicale ou non
Réponse aux traitements médicaux
TRAITEMENTS
Chirurgie: exérèse complète ou non par laparotomie ou laparoscopie ou chirurgie robotique (pays développés avec centres experts)
- STADES:
stade I : tumeur totalement réséquée, de petite taille (< 100 g et < 200 cm3), et normalisation des dosages hormonaux en postopératoire ;
stade II : tumeur totalement réséquée, de taille plus importante (≥ 100 g et ≥ 200 cm3),
Hormonothérapie substitutive
Chimiothérapie et radiothérapie en cas de métastases
Standards
Recommandations locales
SURVEILLANCE
PREVENTION
-Primaire
-Secondaire
-Tertiaire
Cancer du rein
Cancer du rein
- Background
- Définition
Les cancers du rein regroupent un ensemble de tumeurs malignes développées à partir du parenchyme rénal. Bien que les types histologiques varient selon l’âge, 80% des cas sont des néphroblastomes (tumeurs de Wilms).
- Épidémiologie
-Rare : 7-8% des cancers de l’enfant
-Différents type histologique
Néphroblastome (TW): Le plus fréquent, 85%
Carcinome rénale (CR): en deuxième position, 5%
Sarcome à cellule clair (SCC) : en troisième position, 3%
Néphrome mésoblastique (NM): 3%
Tumeur rhabdoïde (TR): 2%
Autres : 2%
Type histologique varie selon l’âge
Age | Fréquent | Possible | Rare |
Naissance | NM | TW | TR |
< 1 an | TW, NM | TR,SCC | |
1 – 5 ans | TW | SCC | NM (<3 ans), TR |
5 – 10 ans | TW | SCC, CR | |
11-15 ans | TW, CR |
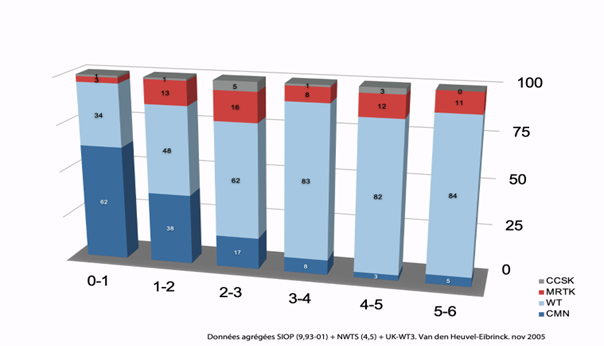
- Particularités
-Contexte génétique dans 10% des cas
Syndrome de WAGR (tumeur de Wilms, Aniridie, anomalies Génito-urinaire, Retard mental)
Syndrome de Denys-Drash (sclérose mésangiale diffuse, anomalies du développement sexuel)
Syndrome de Wiedmann Beckwith (hémihypertrophie, macroglossie, omphalocèle, viscéromégalie)
Syndrome de Simpson-Golabi-Behmel (macrosomie, dysmorphie faciale, malformations vertébrales, anoamlie membres, viscéromégalie, atteinte génitale, déficience intellectuelle)
Syndrome de Perlman
Syndrome de Sotos
- Atteinte rénale propre
- Risque de tumeur controlatérale :Surveillance tous les 3-4 mois pendant 7 ans
- Rappels histologiques
2.1) Néphroblastome
Tumeur associant dans des proportions variables d’une composante épithéliale, d’une composante mésenchymateuse ou stromale et d’une composante blastémateuse +/- Anaplasie (focale, diffuse).
Classification de l’International Society of Pediatric Oncology (SIOP)
- Histologie favorable :
- Tumeur stromale : Prédominance de tissu conjonctif.
- Tumeur épithéliale : Prédominance de structures tubulaires et glomérulaires.
- Tumeur mixte : Composée de tissus stromal et épithélial en proportions variables.
- Histologie défavorable :
- Blastème prédominant : Présence majeure de cellules blastemales, résistant à la chimiothérapie.
- Anaplasie : Caractérisée par une augmentation de la taille nucléaire, un polymorphisme nucléaire, et une hyperchromasie. L’anaplasie peut être focale ou diffuse.
- Anaplasie focale : Zones d’anaplasie limitées et localisées.
- Anaplasie diffuse : Zones d’anaplasie étendues et généralisées.
Classification de l’International Society of Pediatric Oncology (SIOP) et de la Children’s Oncology Group
STADE | COG | SIOP |
I | Tumeur limitée au rein, complètement réséquée Capsule rénale intacte Pas de rupture ni de biopsie Pas de métastases nodales ou hématogènes. | Tumeur limitée au rein, complètement réséquée. Tumeur présente dans la graisse périrénale mais entourée par une (pseudo)capsule fibreuse Tumeur peut montrer une croissance protrusive dans le bassinet ou l’uretère sans infiltrer leurs parois. Pas d’implication des vaisseaux ou des tissus mous du sinus rénal Pas de rupture ou de biopsie avant l’ablation. |
II | Tumeur dans la graisse périrénale mais complètement réséquée. Tumeur infiltre le sinus rénal ou les vaisseaux sanguins et lymphatiques en dehors du parenchyme rénal mais est complètement réséquée. Tumeur infiltre les organes adjacents ou la veine cave mais est complètement réséquée. | Tumeur viable est présente dans la graisse périrénale sans être recouverte par une (pseudo)capsule mais est complètement réséquée (les marges de résection sont saines). Tumeur viable infiltre les tissus mous du sinus rénal. Tumeur viable infiltre les vaisseaux sanguins ou lymphatiques du sinus rénal ou du tissu périrénal. Tumeur viable infiltre la paroi du bassinet ou de l’uretère. Tumeur viable infiltre la veine cave ou les organes adjacents (sauf la glande surrénale) mais est complètement réséquée. |
III | Tumeur résiduelle ou métastases non hématogènes confinées à l’abdomen. Ganglions lymphatiques abdominaux atteints. Implants péritonéaux tumoraux. Rupture de la tumeur avant ou pendant la chirurgie. Résidu tumoral macroscopique dans l’abdomen. Biopsie de la tumeur (y compris la biopsie à l’aiguille fine) avant l’ablation du rein. Marges de résection envahies par la tumeur ou la tumeur est sectionnée pendant la résection (excision en morceaux). | Tumeur viable est présente aux marges de résection. Ganglions lymphatiques abdominaux contiennent une tumeur viable ou non viable. Thrombus viable ou non viable présent aux marges de résection de l’uretère, de la veine rénale ou de la veine cave inférieure. Thrombus tumoral viable ou non viable dans la veine cave inférieure retiré en morceaux par un chirurgien. Rupture tumorale préopératoire ou peropératoire, confirmée par examen microscopique (tumeur viable à la surface du spécimen au niveau de la rupture). Biopsie en coin ou ouverte avant chimiothérapie ou chirurgie préopératoire. Implants tumoraux (viables ou non viables) dans l’abdomen. La tumeur (viable ou non viable) a pénétré la surface péritonéale. |
IV | Métastases hématogènes ou dissémination au-delà de l’abdomen. | Métastases hématogènes (poumon, foie, os, cerveau) ou métastases ganglionnaires en dehors de la région abdomino-pelvienne. |
V | Tumeurs bilatérales au diagnostic ; chaque côté doit être sous-classé selon les critères ci-dessus. | Tumeurs bilatérales au diagnostic ; chaque côté doit être sous-classé selon les critères ci-dessus. |
- Néphrome mésoblastique
Tumeur conjonctive de bas grade avec 3 types histologiques
-Classique (leiomyome-like) = fibromatose infantile rénale
-Cellulaire = fibrosarcome infantiler rénal (Transcrit de fusion ETV6-NTRK3 / EML4–NTRK3)
-Mixte
- Tumeur rhabdoïde
-Tumeur présentant des cellules rhabdoïdes (inclusions éisonophiles intra-cytoplasmiques, noyau volumineux excentré, nucléole proéminent) avec une densité cellulaire forte et des nappes de cellules non cohésives.
-Immunohistochimie : expression de vimentine, cytokératines, EMA, S-100, Desmine, Myoglobine
-Biologie moléculaire : Perte d’expression d’INI1/SMARCB1
- Carcinome rénal
Tumeur d’architecture papillaire avec des microcalcifications
Biologie moléculaire : CK +/- , CD10++, PAX2++, PAX8++, TFE3 ou TFEB : – TFE3 : Melan A et HMB45 +/-, TFE3 +++
- Sarcome à cellule claire
Nids/cordons de cellules tumorales séparés par des septa fibrovasculaires branchés
Immunohistochimie : vimentine, Bcl2, Cycline D1, BCOR
Biologie moléculaire : Transcrit de fusionYWHAE-NUTM2B(FAM22), t(10;17)(q22;p13) :
Transcrit de fusion BCOR-CCNB3 – Enfants plus âgés (8-14ans)
- Diagnostic clinique
- Signes fonctionnels
Asymptomatique
Si compression : douleur, troubles digestifs
- Signes généraux
Fièvre
Perte de poids
Hypertension artérielle
- Signes physiques
-Masse abdominale
Indolore
Contact lombaire
Surface lisse ou bosselée
Consistance ferme ou dure
– Hématurie macroscopique
-Signes de compression : Varicocèle
-Signes de rupture (urgence thérapeutique) : Pâleur, douleur, défense, contracture
-Bandelette urinaire
- Diagnostic paraclinique
- Standards
- Biologie
-NFS, GsRH, hémostase
-Créatininémie, urémie, ionogramme sanguin, ionogramme urinaire
-Calcémie, Catécholamines (sang, urines)
-LDH
-Protidémie
- Imagerie
-Échographie abdomino-pelvienne
Signe de l’éperon
Analyse de la tumeur : Masse solide et ou kystique à échogénicité hétérogène, bien délimitée, avec des zones hypoéchogènes discrètes correspondant à la nécrose, provoquant une distorsion et un déplacement du système collecteur et de la capsule. Apprécier la taille en 3 dimensions.
Rapports vasculaires (Pédicules rénaux, Aorte et ses branches)
Recherche de thrombus (Échographie doppler ++)
Recherche de métastase au niveau du foie ou de l’abdomen
Rein controlatéral
-Radiographie du thorax de face et de profil
Recherche de métastases pulmonaires sous forme de lésions blanches arrondies, souvent situées à la périphérie des poumons.
-TDM TAP avec injection de PDC / TDM Thoracique et IRM Abdomino-pelvienne
Analyse de la tumeur : Masse intrarénale sphérique, hétérogène avec des calcifications et de la graisse. Bien délimitée, avec une atténuation mixte, un léger rehaussement après contraste, des zones kystiques dues à des hémorragies et à la nécrose. Signal faible sur les images pondérées en Hyposignal T1 et hypersignal T2. Apprécier taille dans les 3 dimensions
Anatomie vasculaire
Envahissements
Rein controlatéral
Métastases
Thrombus
– Niveau I: thrombus < 2cm dans VCI
– Niveau II: VCI infra-hépatique
– Niveau III: VCI rétro-hépatique
– Niveau IV: VCI supra-hépatique
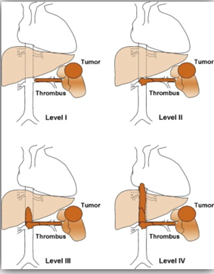
NB : si niveau supérieur du thrombus
- VCI / veines sus-hépatiques : Sd de Budd Chiari aigü
- VCI supra-hépatique : Insuffisance cardiaque aiguë, Embolie pulmonaire
- Diagnostic présomptif de néphroblastome devant :
-Âge (7 mois – 10 ans)
-Rapidité évolutive
-Imagerie typique
- Pas de biopsie, prise en charge thérapeutique sans preuve histologique
- Pas de diagnostic présomptif et indication de biopsie devant :
-Âge > 10 ans
-Infection urinaire
-Biologie atypique : hypercalcémie, Syndrome inflammatoire, élevation des cathécolamines
-Imagerie non typique
Calcifications, adénopathies volumineuses, Parenchyme rénal non visible
-Métastase non habituelle (non pulmonaire, non hépatique)
Procédure biopsie
Voie percutanée postérieure, rétropéritonéale (pas de biopsie transpéritonéale)
Ponction à l’aiguille fine (18 G)
Échoguidée
Contre-indication des biopsies chirurgicales ou avec une aiguille <18G => stade III d’emblée
- Recommandations locales
Biologie
Imagerie : Échographie abdomino-pelvienne, radiographie du thorax F/P et TDM TAP
Même indication de biopsie
- Traitement
- Standards
1) International Society of Pediatric Oncology (SIOP)
- Chirurgie d’emblée
– Nourrissons < 3 mois, adolescents
– Tumeurs kystiques sans composante charnue
– Urgence chirurgicale
Rupture tumorale avec hémodynamique instable
Occlusion réfractaire au traitement médicale
- Chimiothérapie pré-opératoire
-7 mois à 7 ans
-Entre 3 et 6 mois : discussion de l’indication en RCP
-Entre 7 ans et 10 ans : Discussion de l’indication en RCP
Actinomycine-D
Vincristine
Adriamycine
- Chirurgie
-Après 4 semaines de chimiothérapie
-Après 6 semaines de chimiothérapie : métastases, thrombus cave, bilatérales
- Néphrectomie totale élargie (R0)
Abord transversale en débordant la ligne médiane Transpéritonéale
Décollement colo-pariétal et cadre duodénal pour accéder à la VCI
Rester à l’extérieur de la loge rénale
Décoller rein latéralement et en bas
Ligature de l’uretère le plus bas possible
Abord de l’axe aorto-cave de bas en haut
Tumeur G : attention à Artère rénale droite et AMS / Tumeur D : attention à Veine rénale G
Si thrombus VCI infradiafragmatique et infrahépatique non adhérent : extraction par cavotomie ou par cathéter à ballonnet de Fogarty ou de Foley
Isoler pédicule
Ligature artère rénale puis veine rénale
Picking ganglionnaire (> 7 ganglions) : Hilaire, espace aorto-cave, à distance si anormalement large
- Chirurgie conservatrice
-Indications
Sur décision RCP
TW bilatérale ou sur rein unique
TW sur syndrome prédisposant
Conditions
Tumeur unifocale & polaire
Périphérique ou centrale mais à distance des éléments vasculaires
Faible volume (<300mL), stable ou régressive sous CT
Limites
Absence de rupture préopératoire
Nettes avec le parenchyme sain
Sans envahissement pyélo-caliciel
Pas thrombus veineux
Pas d’envahissement LN
Pas d’infiltration organes de voisinage
Préservant > 50% parenchyme rénal sain
Technique
Abord de la loge rénale
Repérage (imagerie 3D, échographie per-opératoire)
Préservation parenchyme rénal
Peu de clampages
Vasodilatateurs
- Compte rendu-post-opératoire
Stade chirurgical
Stade I : La tumeur est réséquée avec une marge claire.
Stade II : La tumeur est macroscopiquement complètement réséquée.Il y a des ganglions abdominaux impliqués (suspectés).
Stade III : La tumeur est incomplètement réséquée ou rompue, ou il y a une extension vasculaire.
Poids de la tumeur
Inspection rein controlatéral si indiqué
Apparence veine rénale, veine cave, capsule tumorale ganglions lymphatiques : (normaux, suspects, paroi infiltrée, thrombose)
Excision complète ou incomplète, ou la biopsie, seront également enregistrées
Autre structure suspecte ou envahie Complications rupture tumorale (majeure/mineure), hémorragie importante (> 50 ml/kg), hypotension, arrêt cardiaque, lésion vasculaire, obstruction de la veine cave inférieure, infarctus intestinal, lésion intestinale, lésion splénique, lésion hépatique
Résection ou biopsie autre organe viscéral (en raison d’une lésion)
- Chimiothérapie et Radiothérapie postopératoire
Fonction du stade local
Fonction des résultats anatomopathologiques
Chimiothérapie
Tous les patients sauf ceux ayant une tumeur de stade I à faible risque.
Actinomycine-D, Vincristine, Adriamycine, Etoposide, cyclophosphamide, Carboplatine
Radiothérapie
Délai : 10 jours suivant la chirurgie
Radiothérapie abdominale totale : histologie de risque intermédiaire ou élevé avec une rupture tumoral majeur préopératoire ou peropératoire, ou dépôts péritonéaux macroscopiques
Radiothérapie locale : Stade III et stade IV
Radiothérapie pulmonaire : métastases pulmonaires persistante après dixième semaine postopératoire.
2)Protocole Children’s Oncology Group (COG, NTWS)
- Chirurgie d’emblée
Devant toutes les tumeurs opérable
Si tumeur très volumineuse : biopsie
- Chimiothérapie pré opératoire
– tumeur non opérable
– thrombose de la veine cave
Doxorubicin, Dactinomycin and Vincristine
- Chimiothérapie adjuvante
Tous les patients
Exception : enfants de moins de 2 ans avec tumeur de stade I à histologie favorable pesant moins de 550 g, ayant des ganglions lymphatiques prélevés et confirmés négatifs.
- Radiothérapie postopératoire
Délai : 10 jours suivant la radiothérapie
Tous les patients stade III, au niveau du lit tumoral
- Recommandations locales
Recommendations de l’International Society of Pediatric Oncology (SIOP)
- Surveillance
Trois premières années : Examen physique et échographie abdominale
Tous les 3 mois pendant la première année
Tous les 6 mois pendant deuxième et troisième année
- Prévention
- Secondaire
-Surveillance des patients à risque génétique : Examen physique et échographie abdominale tous les 3 mois pendant 7 ans.
-Dépistage prénatal : Identification précoce de malformations pouvant passer inaperçu à la naissance et pouvant rentrer dans un cadre syndromique prédisposant.
-Conseil génétiques : Pour les familles avec une histoire de syndromes héréditaires pour identifier les enfants à haut risque.
- Tertiaire
-Suivi post-traitement rigoureux : Suivi régulier après traitement selon les recommandations,
-Réhabilitation et soins palliatifs : Pour les patients ayant survécu au cancer, fournir des services de réhabilitation pour traiter les effets secondaires à long terme du traitement
PHEOCHROMOCYTOMES ET PARAGANGLIOMES
PHEOCHROMOCYTOMES ET PARAGANGLIOMES
Les phéochromocytomes (PHEO) sont des tumeurs de la médullosurrénale et les paragangliomes (PGL) sont développés aux dépens du tissu chromaffine extra-surrénalien, c’est-à-dire associé aux ganglions sympathiques (au niveau du thorax, de
l’abdomen et du pelvis) ou parasympathiques (au niveau du cou et de la base du crâne)
Quarante pour cent des phéochromocytomes/paragangliomes sont héréditaires dans le cadre de différents syndromes de prédisposition (maladie de Von Hippel Lindau, neurofibromatose de type 1, néoplasie endocrinienne multiple de type 2, paragangliome héréditaire, phéochromocytome familial, etc.).
Leur prise en charge est assurée dans les pays développés par des centres experts pluridisciplinaires .
-Epidémiologie
L’incidence des phéochromocytomes/paragangliomes est esti
mée à 0,66/100 000 dont 10–20 % sont métastatiques
-Prédispositions
NEM2, Maladie de Von Hippel Lindau, NF1
DIAGNOSTIC CLINIQUE
Ils peuvent être révélés par un tableau clinique évocateur d’une secrétion catécholaminergique anormale (HTA maligne, céphalées, sueurs,…), un syndrome tumoral (signes de compression )une complication aiguë (AVC, convulsions …), un dépistage familial pré-symptomatique,
DIAGNOSTIC PARACLINIQUE
-Standards
BiologieBiologie: sur sang et urines
GlucoC:cortisol
minéralloC: aldostérone, rénine
Stéroides: testostérone, oestradiol, DHEA-s
Imagerie: TAP-TDM, IRM abdominale, TEP-68GA DOTATOC
Stadification TNM PHEO/PGL AJCC
I:T1, N0, M0
II :T2, N0, M0
III :T1–T2, N1, M0
T3, N0–N1, M0
IV:T1-T3, N0–N1, M1
T1 : tumeur inférieure à 5 cm, pas d’invasion extra-surrénalienne ; T2 : tumeur d’au
moins 5 cm, ou paragangliome sympathique quelle que soit la taille, pas d’invasion
extra-surrénalienne/extra-tumorale ; T3 : tumeur quelle que soit la taille avec
invasion des tissus environnants (foie, rate, pancréas, rein) ; N0 : pas de ganglion
envahi ; N1 : présence de ganglions envahis régionaux ; M0 : pas de métastase
à distance ; M1a : présence de métastases à distance seulement osseuse ; M1b :
présence de métastases à distance seulement ganglionnaire à distance/foie/pou
mon ; M1c : présence de métastases à distance à l’os et autres sites multiples.
La biopsie des tumeurs surrénaliennes localisées, résécables est
habituellement contre-indiquée
Biopsie scanno-guidée oubien sous écho-endoscopie par un radiologue expérimenté en cas de métastases synchrones ou de tumeur non résécable,
surtout chez un patient sans hypersécrétion hormonale, la
microbiopsie peut être envisagée à visée diagnostique
Anatomo-pathologie
Tumeur neuro-endocrine non épithéliale
IHC: positivité des marqueurs chromogranine Asynaptophysine, INSM1), des
biomarqueurs fonctionnels (tyrosine hydroxylase et dopamine
beta-hydroxylase), et GATA-3 et des cellules sus tentaculaires
pour PS100 et SOX10 ; par contre négativité des kératines
Oncogénétique
Une vingtaine de gènes impliqués
Mutation des gènes SDHB, SDHD, VHL, RET et NF1
TRAITEMENTS
Chirurgie
Le contrôle du syndrome sécrétoire est essentiel avant toute
chirurgie ou traitement systémique
Traitement anti-HTA
Chirurgie de la tumeur primitive
L’exérèse chirurgicale complète est le traitement curatif des
phéochromocytomes/paragangliomes.
Chirurgie partielle possible en cas de prédisposition à la bilatéralité dans les syndromes génétiques cités plus haut
Laparotomie recommandée dans notre contexte même si les voies mininvasives ont du succès dans les centres experts des pays développés
Chirurgie aussi en cas de rechutes locales et/ou métastases résécables
Radiothérapie externe et techniques de radiologie interventionnelle comme la chimioembolisation sont indiquées pour les localisations métastatiques non résécables
Chimiothérapie:
Cyclophosphamide, vincristine, dacarbazine
chez les patients atteints de phéochromocytome et
paragangliomes métastatiques qui n’ont pas de fixation signi
ficative en imagerie fonctionnelle, qui progressent rapidement,
et/ou associée à une charge tumorale élevée ou un caractère
Symptomatique
Immunothérapie/Hormonothérapie
LES TUMEURS DU FOIE DE L’ENFANT
LES TUMEURS DU FOIE DE L’ENFANT
Les tumeurs du foie représentent 1-2% de l’ensemble des tumeurs pédiatriques
Le tier est représenté par les tumeurs bénignes: hamartome, hémangiome, hyperplasie nodulaire focale, adénome.
Les deux tiers représentent les tumeurs malignes: hépatoblastome, carcinome hépato-cellulaire, tumeurs mésenchymateuses malignes, angiosarcome, carcinome fibro-lamellaire.
RAPPELS
-Anatomie
Segmentation hépatique de Couinaud
Foie droit: segments V à VIII
Foie gauche: segments II, III, IV
Lobe droit: segments IV à VIII
Lobe gauche: segments II et III
-Anatomo-pathologie
hépatoblastome, carcinome hépato-cellulaire, tumeurs mésenchymateuses malignes, angiosarcome, carcinome fibro-lamellaire.
- L’hépatoblastome
- Epidémiologie
La plus fréquente des tumeurs malignes du foie et la plus fréquente des tumeurs du foie chez l’enfant (0,5 à 1,5 / million avant 15 ans)
Il survient dans 80% des cas chez l’enfant de moins de trois ans.
- Facteurs prédisposants: hémi-hypertrophie corporelle, syndrome de Beckwith-Wiedman, polyadénomatose familiale, prématurité (risque relatif corélé au poids de naissance), syndrome de Li-Fraumeni.
Anatomo-pathologie: tumeur le plus souvent unifocale, parfois bi ou multifocal,
tumeur mixte épithéliale et mésenchymateuse
- Diagnostic Clinique
Sur le plan clinique il se révèle par une masse abdominale asymptomatique. Plus rarement, une anorexie, des douleurs abdominales, une perte de poids, des nausées et vomissements, un ictère par compression des voies biliaires.
- Paraclinique
Biologie
-l’alpha-foeto-protein est très élevé: 10.4 à 10.7ng/ml dans 90% des hépatoblastomes. Lorsqu’il est inférieur à 100ng/ml on parle d’hépatoblastome non secrétant. Elle n’est pas spécifique. Elle a un intérêt dans l’évaluation de la réponse et le suivi du patient.
-L’ HCG est parfois élevée
– la thrombocytose est présente dans 20% des cas. Le bilan hépatique est normal
Imagerie
–L’échographie précise le siège hépatique, les caractéristiques et les limites de la masse. Elle décrit une masse tissulaire plutôt homogène (formes épithéliales) ou hétérogène (formes mixtes). La tumeur est limitée, polylobée, pouvant comporter des septa, des calcifications et parfois des zones de nécrose. Les formes kystiques sont exceptionnelles. Il existe des formes multiples et parfois diffuses, rares et de mauvais pronostic. L’étude doppler trouve parfois des signes d’hypervascularisation mais s’attache surtout à rechercher des signes de thrombose veineuse.
-L’étude de l’extension intra-hépatique de la tumeur est mieux faite par la TDM et l’IRM.
L’extension est précisée selon la segmentation hépatique de Couinaud qui tient compte de la vascularisation hépatique et permet de déterminer l’opérabilité de la tumeur.
L’extension locale est appréciée selon la classification PRETEXT (Pre-Treatment Extent) du groupe SIOPEL (5 catégories)
I:trois secteurs hépatiques contigus non atteints
II:atteinte de deux secteurs contigus
III: atteinte de trois secteurs contigus ou atteinte de deux secteurs non contigus
IV: atteinte des 4 secteurs
V: atteinte de la veine cave ou une veine sus-hépatique (V), de la veine porte ou une de ses branches (P), ailleurs dans l’abdomen (E)ou atteinte extra-abdominale (M)
-TDM thoracique pour la recherche de métastases pulmonaires (Rx poumons n’a de valeur que si positive)
Le pronostic varie selon la résectabilité tumorale qui est fonction de l’extension tumorale , la multi-focalité, l’envahissement vasculaire et la présence de métastases au diagnostic.
– Le diagnostic est confirmé par l’étude histopathologique d’une biopsie percutanée et ensuite de la pièce d’exérèse.
– Facteurs pronostiques
Les taux d’alpha-foetoprotéine,
l’âge du patient,
la présence de métastases et
la classe « Pretreatment Extent of Disease (PRETEXT) » allant de I à IV,
le facteur d’annotation PRETEXT, il est positif si un des cinq facteurs suivants est présent:
une atteinte de la veine cave, des trois veines hépatiques ou les deux
une atteinte de la bifurcation porte ou des deux veines portes droite et gauche ou les deux
une extension tumorale contiguë extrahépatique
une tumeur multifocale du foie
une rupture tumorale au diagnostic.
Groupes de risque
-les formes de risque standard
Absence de tumeur extra-hépatique (métastase)
1 à 3 secteurs hépatiques concernés (I-III)
AFP sup à 100 g/mL
Pas de rupture tumorale
– les formes de haut risque caractérisées par la présence d’au moins un des facteurs suivants :
présence de métastases,
atteinte diffuse du foie,
taux d’alpha-fœto-protéine normal,
rupture tumorale,
envahissement vasculaire
âge de l’enfant supérieur ou égal à 8 ans.
- Traitement
Le traitement de l’hépatoblastome est basé sur la chimiothérapie systémique et la chirurgie.
La chimiothérapie
Son but est la réduction du volume tumoral et la prophylaxie des métastases
Elle est indiquée pour les tumeurs localisées au foie, volumineuses, centrales à priori chimiosensibles et les tumeurs métastatiques
Drogues efficaces:
dérivés du platine: cisplatine et carboplatine
anthracyclines,
5-Fluoro-uracile,
Vincristine
La chirurgie
A réaliser par des chirurgiens pédiatres expérimentés dans un cadre dédié en équipe pluridisciplinaire (anesthésiste, radiopédiatres spécialisés dans ce type de chirurgie) et qui peuvent faire appel au besoin à des spécialistes d’adulte (chirurgiens vasculaires, thoraciques ou autres)
Elle est indiquée en première intention pour les petites tumeurs périphériques, non ou peu chimiosensibles et en seconde intention après une chimiothérapie de réduction tumorale ou de contrôle des métastases en cas de tumeur résécable (PRETEXT I à III)
On peut réaliser une segmentectomie, une lobectomie, une résection cunéiforme ou une hépatectomie
la transplantation hépatique, offre un bon taux de survie à long terme lorsque la tumeur est non résécable (environ 60% des cas) et que la chimiothérapie ne parvient pas à réduire la tumeur à une taille résécable. Elle n’est pas réalisable au Sénégal pour le moment
la radiothérapie
dont les bénéfices demeurent incertains malgré quelques cas non résécables répondant bien
La résection chirurgicale associée à la chimiothérapie néo-adjuvante permet un taux de guérison supérieur à 70%
- L’hépatocarcinome
2ème tumeur hépatique de l’enfant, 23% des masses hépatiques
10 cas/an en Europe
Facteurs prédisposants
Hépatite virale chronique B ou C, Glycogénose de type 1 ou 3, Tyrosinémie, Maladie de Byler ou cholestase fibrogène familiale, Atrésie des voies biliaires, Déficit en alpha-1-antitrypsine, Hémochromatose, Shunt portocave spontané ou chirurgical
Grands enfants (5ans) et adolescents (12 ans)
Clinique: signes d’altération de l’état général
L’élevation du tauxd’AFP est présente dans 2/3 des cas
3 types de CHC
-CHC sur maladie pré-existante du foie (50%)Hépatite B, tyrosinémie, CPIF, glycogénose, autres cirrhoses
Biologie hépatique +/- perturbée, secrétion d’AFP inconstante
Chimiosensibilité médiocre
Mauvais pronostic
-Carcinome fibro-lamellaire du foie
forme d’hépatocarcinome sur foie sain, de meilleur pronostic
Prédominance féminine
Souvent symptomatique
AFP normale
Imagerie: tumeur assez bien limitée, souvent hétérogène peu vascularisée
Rechutes locales et métastases pulmonaires fréquentes
Survie à 5 ans : 50% environ
Traitement chirurgical, transplantation d’emblée discutable
-Formes transitionnelles
Tumeurs intermédiaires entre HB et HCC
Surviennent sur foie sain
AFP élevée
Traitement:
Chimiothérapie PLADO+Nexavar
- Le syndrome de PEPPER cf neuroblastome
- LYMPHOMES
- METASTASES HEPATIQUES D’AUTRES TUMEURS (néphroblastome, neuroblastome)
PROTOCOLES VALIDES DANS LE CADRE DE LA SIOPEL
Risque standard: SIOPEL 6 (Cisplat)
PRETEXT IV: SIOPEL 3-HR (CDPP-carbo-Doxo)
Métastatiques: SIOPEL 4 (CDPPhebdo-doxo)
Rupture: SIOPEL-4
AFP<100: SIOPEL -4 (éliminer tumeur rhabdoide)
HCC: PLADO
TUMEURS SACRO-COCCYGIENNES
TUMEURS SACRO-COCCYGIENNES
-Introduction
Tumeurs congénitales développées aux dépens du coccyx
Appartiennent au groupe des tumeurs germinales (c’est à dire développées à partir des cellules germinales « primordiales » totipotentes)malignes extra-gonadiques et extra-cérébrales.
-Epidémiologie
2ème localisation des TGM après la localisation gonadique
RAPPELS
-Embryo-pathologie
Théorie de Teillium:4-6ème semaine in utéro: migration des cellules germinales du sac vitellin vers la crête génitale
Histologie:
Prénatales et néo-natales: bénignes, ce sont des tératomes
À partir de 4 mois: malignes, ce sont des tumeurs vitelines
DIAGNOSTIC CLINIQUE
- du sillon interfessier
- signes de compression pelvienne (f.endopelvienne) rétention d’urine, constipation
- signes neurologiques
– radiculaires
– compression médullaire (méta vertébrales)
- Surveillance biologique d’un tératome néo-natal
DIAGNOSTIC PARACLINIQUE
TDM
Classification de Altmann
I: tumeur du sillon interfessier
II: tumeur exo-pelvienne
III: tumeur endo et exo-pelvienne
IV: tumeur endopelvienne
Marqueurs:
-alpha-FP,
-HCG totaux (alpha+béta) en mUI/mL: inérêt dans le diagnostic positif (pas de biopsie ) et dans la surveillance post-traitement (détection des rechutes)
BILAN D’EXTENSION: TAP-TDM ou TDM poumons+écho abdo
Stades cliniques
CS I : T < 5 cm, gg = 0, méta = 0
CS II : T > 5 cm, gg = 0, méta = 0
CS III : extension loco-régionale, méta = 0 III A : par atteinte gg III B : autre que gg (péritoine, ascite)
CS IV : présence de métastases
TRAITEMENT
Avant trois mois: chirurgie d’exérèse uniquement
Surveillance des marqueurs
Après trois mois:
Non secrétante: chirurgie
Secrétante: chimiothérapie puis chirurgie
Drogues : cisplatine, bléomycine, etoposide
Chirurgie; exérèse complète de la tumeur et du coccyx
Stades chirurgicaux
PS I = T localisée à l’organe d’origine complètement enlevée
PS II = T. avec extension à l’extérieur de l’organe d’origine, complètement enlevée
PS III = Extension régionale
III a : exérèse microscopiquement incomplète
III b : exérèse macroscopiquement incomplète
III c : biopsie